약동-약력학 모델링과 신약 개발
서울아산병원 임상약리학과 임형석 교수
1. 약동학 (Pharmacokinetics) 및 약력학 (Pharmacodynamics)
약을 투약하면 아래 그림 1과 같이 약동학 및 약력학적인 과정을 거쳐서 치료효과 및 이상반응이 발현된다. 따라서 약동학과 약력학은 약의 특성을 이해하기 위한 기본적인 정보이다.
약동학은 약의 용량과 체내 약물 농도 관계를 설명하는 학문이다. 약물의 농도는 현실적인 이유로 많은 경우 혈중 농도를 대상으로 한다. 약동학은 흔히 ADME (absorption, distribution, metabolism, excretion)의 학문이라고 말한다. 그 이유는 ADME 각각의 과정이 약물의 이동량과 속도를 파악하면 임의의 용량 용법에서 시간에 따른 혈중 약물 농도를 정확히 기술할 수 있기 때문이다. 따라서 약동학적 분석은 해당 약물의 ADME 과정을 정량적으로 파악하는 것으로 이해될 수 있다.
약력학의 관심 대상은 치료효과 및 이상반응이다. 치료효과 혹은 이상반응을 약물의 용량 이나 농도로 설명, 즉 용량 혹은 농도와 효과 사이의 관계를 연구하는 학문이다. 약의 효과는 경험적으로 최대효과모형, 즉 약의 용량을 증가시키면 효과도 증가하지만 특정 용량 이상에서는 더 이상 효과의 증가가 없는 것으로 알려져 있다. 최대효과모형을 구성하는 주요 파라메터로는 최대효과를 나타내는 Emax, 효능 (potency)을 나타내는 EC50 등이 있다.
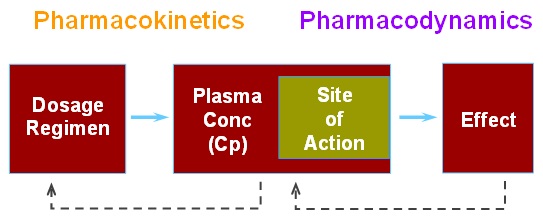
그림 1. 약동학과 약력학의 관계
약물의 약동학 및 약력학적 분석에 있어서 주요 파악 대상으로는 “평균적인 관계” 뿐 아니라 “개인 간 차이”도 있다. 개인 간 차이는 또한 예측할 수 있는 차이와 예측불가능한 차이로 구분할 수 있다. 예측할 수 있는 차이는 예를 들어 warfarin 치료 효과의 개인 간 차이 중 해당 환자의 CYP2C9 유전형으로 예측될 수 있는 부분을 말한다. Warfarin의 치료효과 차이를 CYP2C9 유전형으로 일부 설명할 수 있지만 같은 CYP2C9 유전형을 지닌 환자들 사이에서도 치료효과의 차이는 존재하며 이와 같은 것이 예측 불가능한 차이로 볼 수 있다. 예측 불가능한 개인 간의 차이가 크다는 것은 약물 투약 시 치료효과의 예측 가능성이 적음을 시사하는 소견이므로 이러한 약물 반응에 있어서 예측 불가능한 개인 간 차이의 크기는 약의 중요한 정보로 간주될 수 있다.
2. 약동-약력학 모델링과 시뮬레이션, 그리고 임상시험 시뮬레이션
모델은 설명변수와 설명변수에 의해 영향을 받는 종속변수와의 관계를 수식으로 정량적으로표현한 것이다. 약동-약력학 모델링은 약물 투여 후 관찰되는 농도나 효과 등의 현상이 일정한 규칙을 따라 발현된다는 가정 하에 이러한 규칙을 잘 기술하는 수학적인 수식 즉 모델을 찾아내는 과정이다. 모델링의 목적은 크게 기술 (description)과 예측 (prediction)이라 할 수 있다. 일견 불규칙해 보이는 농도나 효과의 관측값을 모델링을 통해 분석함으로써 그 의미를 이해 할 수 있으며, 더 나아가 모델 식을 이용한 시뮬레이션을 통해 여러 다양한 상황에서의 약동-약력학적 결과를 예측하고 약동-약력학 모델의 의미를 좀더 명확히 파악할 수 있다.
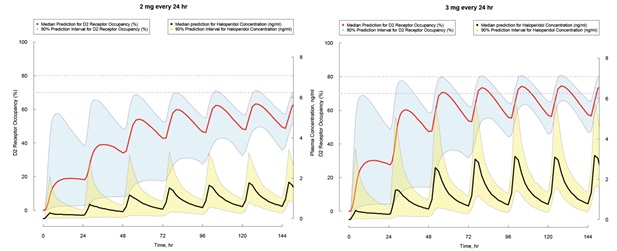
그림 2. 여러 용량으로 haloperidol 반복 투여시 stochastic simulation에 의한 혈중 약물 농도와 haloperidol-Dopamine type 2 (D2) 수용체 결합 변화에 대한 예측
*파란 범위와 노란 범위는 각각 D2 수용체 결합과 혈중 농도 변화의 90% prediction interval이고 붉은 선과 검은 선은 각각 D2 수용체 결합과 혈중 농도 변화의 median 값에 대한 예측 값임
약동/약력학 모델링 과정이 데이터로부터 용량-농도-반응 사이의 관계를 파악하는 과정이라면, 시뮬레이션은 반대로 모델을 이용하여 특정 상황(용량, 용법 등)에서의 반응에 대한 자료를 예측하는 것이다. 시뮬레이션은 deterministic simulation과 stochastic (혹은 Monte-Carlo) simulation으로 구분할 수 있다. 전자가 모델에서 “평균적인 반응에 대한 예측”이라면, 후자는 대개 여기에 “개인간 편차”도 감안한 시뮬레이션이라고 할 수 있다. Stochastic이라는 용어에서 알 수 있듯이 개인간 편차라는 무작위효과가 고려된 시뮬레이션으로서, 그 결과는 95% 혹은 90% prediction interval 등으로 제시되며 이를 통해 실재하는 생물학적 현상인 약물반응의 개인간 편차의 크기를 알 수 있다. 그림 2의 파란색과 노란색 범위는 haloperidol 투여시 해당 약동-약력학 모델을 이용한 stochastic simulation의 결과 예측된 haloperidol에 의한 Dopamine type 2 (D2) 수용체 결합과 혈중 농도 변화에 대한 90% prediction interval이며, 이는 대략적으로 특정 인구 집단의 90%의 사람에서 보일 수 이는 범위에 대한 모델의 예측값이다.
임상시험 시뮬레이션은 임상시험을 컴퓨터 상에서 가상적으로 수행하는 것이다. 이를 통해 최적의 임상시험 디자인을 설계하는 등 다양한 상황에 활용할 수 있다. 임상시험은 약과 사람에서의 반응을 표현하는 약동 혹은 약력학 모델을 이용한 단순 시뮬레이션과는 달리 실제 임상시험에서 있을 수 있는 요소들이 반영되어야 하므로 이에 따라 아래와 같은 추가적인 요소가 필요하다.
표1. 임상시험 시뮬레이션의 구성 모델
| Covariate distribution model |
- 집단 내 demographic covariate의 분포 양상 (예, 나이, 몸무게, 체중, 유전형, 성별, 질환의 중증도, 병용투여 등등)
- 이로부터 가상 피험자 생성 |
| Input / Output model |
- 약물 자체에 대한 모델, 질환에 대한 모델
- Pharmacokinetic, pharmacodynamics model
- Disease progress model
- Placebo response model |
| Trial Execution model |
| - 임상시험 디자인 (protocol)
Dose regimen, number of subjects, number of treatment arms, dosing times, sampling times, selection criteria, lead-in period, etc.
- Deviation from the protocol
Compliance, drop-out, missing data, adaptive design etc.
|
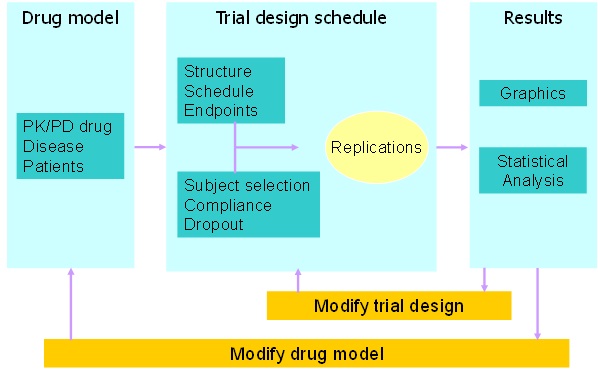 |
| 그림 3. Clinical Trial Simulation의 활용 예: Computer-Aided Trial Design (CATD) |
3. 집단 약동학/약력학 (Population Pharmacokinetics / Pharmacodynamics)
집단 약동학 및 약력학은 좁게는 비선형혼합효과 모형 (nonlinear mixed effect modeling)에 의한 분석을 의미한다. 여기서 혼합효과란 고정효과 (fixed effect)와 무작위효과 (random effect)를 일컫는다. 다시 말하면 고정효과와 무작위효과 (대개 개인간의 편차를 의미함)라는 두 가지 설명변수를 동시에 이용하여 약동학 및 약력학 자료를 모델링에 의해 설명하는 것이다. 혼합효과로 자료를 설명하게 되면 약동학 및 약력학 분석의 단위를 개개인이 아닌 집단으로 할 수 있으며, 그 결과 개개인의 경우에
적은 수 (sparse)의 비균형적 (unbalanced) 자료를 가지고 있지만 여러 사람의 자료를 모으면 많은 수의 균형적인 자료가 될 경우에도 분석이 가능하다.
동일한 약물을 동일한 용량, 용법으로 투여하였는데도 불구하고 치료효과 및 부작용의 차이가 있다는 것은 이들 치료 결과에 영향을 주는 약물 이외의 다른 요소가 있다는 것을 의미하며 이러한 요소를 찾아내는 것은 약물의 개인별 최적화된 약물치료를 위해서도 필수적인 정보이다 (그림 4).
개개인별로 적은 수의 자료로도 분석이 가능한 것은 집단약동-약력학의 매우 중요한 특징이다. 이러한 특성은 임상시험 디자인의 유연성을 높여 선택의 폭을 넓히며, 임상시험에 참여하는 개별 피험자들의 임상시험 참여에 대한 부담을 줄여 더 많은, 더 다양한 특성을 지닌 (heterogenous) 환자들을 대상으로 할 수 있다. 그럼으로써
약물 치료 시, 치료효과 및 부작용의 개인간 차이에 영향을 미치는 요소를 발견할 가능성을 높인다.
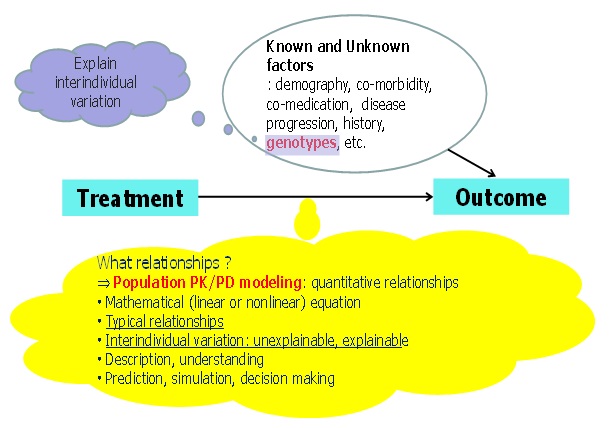 |
| 그림 4. 약물치료와 치료 결과의 다양성 |
4. 신약 개발에 있어서 모델링 및 시뮬레이션의 활용
신약 개발은 막대한 자금과 오랜 기간이 소요되는 과정이며 약물 개발의 실패율도 높아서 한 통계에 의하면 임상 단계에 진입한 약물이라도 10% 가량만이 미국 FDA의 승인을 받는 것으로 알려져 있다. 이러한 상황에서 개발 중인 신약에 대한 “
Early characterization”이 강조되고 있다. 즉 신약 개발 단계에서 가능한 초기에 약물의 특성을 정확히 파악하고 이에 근거하여 합리적이고 올바른 의사 결정을 하여 약물 개발의 실패 확률을 줄이고 적은 비용으로 단기간에 신약을 개발하고자 하는 노력이 이루어지고 있다. 최근 강조되고 있는 biomarker, exploratory IND 등의 개념도 이러한 맥락에서 이해될 수 있으며
system pharmacology, physiology based PK/PD 등과 함께
PK/PD modeling 및 simulation은 핵심적인 기술로 인식되고 있다. 모델링은 흩어져 있는 데이터들을 모아서 유용한 정보로 재가공하는 과정이며, 시뮬레이션은 모델을 이용하여 여러 상황 (various what if scenarios)에서의 결과를 미리 예측하고 이에 기반한 합리적, 과학적 의사 결정에 도움을 준다. 모델링 및 시뮬레이션은 약물 개발의 여러 단계, 다양한 상황에서 두루 응용될 수 있은 매우 유용한 방법론이다. 시뮬레이션의 주요 사용 방법의 하나가 bridging strategy를 이용하는 것일 것이다. 즉, 기존에 잘 알려진 약물의 특성을 최대한 활용하여 새로운 약물을 효율적으로 개발하거나 적응증의 확장에도 이용할 수 있다.
시뮬레이션에서의 중요한 이슈 중의 하나는 과연 시뮬레이션이 현실을 잘 반영하는지 여부일 것이다. 즉 시뮬레이션 값이 실제로 같은 상황하의 실제 시험에서 관측되는 값과 일치하는지 여부일 것이다. 시뮬레이션이 현실을 잘 반영하기 위해서는 여러 가지 요건이 충족되어야겠지만 가장 중요한 요소는 시뮬레이션에 사용된 모델 자체의 특성일 것이다. 즉 모델이 약물의 기전을 잘 반영하고 있으며, 모델이 여러 다양한 데이터로부터 수립되어 robust하며, validation이 잘 되어 있고, 모델을 구성하고 있는 파라메터 추정치들 간의 correlation이 적은 등등의 여러 특성을 지니고 있는지에 대한 평가가 시뮬레이션 결과의 활용 이전에 선행되어야 할 것이다.
신약개발에 PK-PD modeling 및 simulation의 활용은 전세계적으로 짧은 기간 급속히 증가하였으며 앞으로도 이러한 추세는 지속될 것으로 보인다. 최근에는 이전의 경험적인 modeling에서 mechanism based modeling, physiology based PK/PD modeling 등 기전을 반영한 모델링이 강조되고 있으며, 모델링 대상도 비임상 동물실험 및 discovery 단계로 확대되고 있다. 또한 system pharmacology 등 약 자체의 특성과 생물학적 특성의 정보를 종합하여 약물 투여 후의 반응을 조기에 예측하려는 신생 학문 분야도 발전하고 있다. 따라서 국내 신약 개발에 있어서도 PK-PD modeling 및 simulation에 대한 보다 많은 관심과 관련 전문가의 체계적인 양성이 필요할 것이다.



