신약개발에서 1상 임상시험의 역할
서울아산병원 임상약리학과 임형석 교수
1. 1상 임상시험의 전통적 역할
신약개발에서 1상 임상시험의 전통적인 역할은 신약의 안전성과 약동학의 평가이다. 1상 임상시험은 비임상 단계에서 임상 단계로 진입하는 초입 단계이며 이 과정에서 사람에서 견딜 수 있는 내약용량 (tolerable dose range)을 안전성이 허용하는 범위에서 충분히 높은 용량까지 올바르게 평가하는 것이 중요하다. 시험약의 효력 (efficacy) 및 효과 (effectiveness)를 평가하는 이후의 임상시험은 이러한 내약용량 범위 이내에서 이루어지게 된다. 따라서 만약 1상 단계에서 내약용량 범위가 충분히 확보되지 않으면 이후의 임상시험에서 테스트 할 수 있는 용량은 제한될 수 밖에 없다.
2. 1상 임상시험 디자인
1상 임상시험의 피험자는 세포독성항암제 등의 일부 예외적인 경우를 제외하고 개발 약물의 치료 대상 환자가 아닌 건강한 성인 자원자를 대상으로 한다. 이는 대부분의 1상 임상시험의 1차적인 목적이 약효의 평가가 아닌 안전성의 평가인 것과 관련이 있다. 그 밖에도 현재의 표준 치료를 받아야 할 환자를 대상으로 치료 효과 여부가 아직 불확실한 약물을 최적의 용량, 용법이 결정되지 않은 상태에서 투약하는 것은 윤리적으로 바람직하지 않으며, 건강한 성인 자원자가 만약 발생할 수도 있는 이상반응에 견딜 수 있는 능력이 크다는 등의 이유도 있다.
1상 임상시험 계획서의 피험자 선정기준(selection criteria)은 일반적으로 매우 까다롭다. 1상 임상시험에 참여할 수 있는 피험자는 나이, 체질량지수(body mass index), 흡연력, 음주 상태, 질환 및 수술 병력 등의 여러 조건을 만족시켜야 한다. 이는 1상 임상시험의 내적타당도(internal validity)를 높이기 위한 전략으로 볼 수 있다. 즉 시험약물과약물에 의한 이상반응의 관계 평가가 1상 임상시험의 목적이라면 최대한 균질한(homogeneous) 피험자들을 대상으로 수행해야지만 시험약물 투여 후 관찰되는 이상반응과 시험약물 사이의 인과관계 평가가 올바르게 이루어질 수 있기 때문이다. 다시 말하면 매우 다양한 인구학적 및 병력 특성을 가진 피험자들을 대상으로 1상 임상시험을 수행하면 시험약물 투여 후 발생하는 이상반응이 시험약에 의해 발생하는 것인지, 해당 피험자의 특성에 의해 시험약과 무관하게 나타나는 것인지 판단하기 어렵다. 임상시험 디자인에 있어서 내적타당도의 확보는 1상 임상시험을 포함한 약물에 대한 지식을 상대적으로 적게 가지고 있는 조기임상시험 단계에서 더욱 중요하다고 할 수 있으며, 2상 임상시험의 피험자 선정기준이 3상 임상시험의 기준보다 다소 엄격하다는 점도 이러한 관점에서 이해될 수 있다. 하지만 3상 임상시험과 같은 후기 임상시험으로 갈수록 임상시험 디자인의 내적타당도는 여전히 중요하지만 시험의 외적타당도(external validity), 즉 일반화가능성(generalizability) 또한 중요해진다. 3상 임상시험의 피험자 선정기준이 상대적으로 덜 엄격하며 임상시험을 마치 실제 진료행위와 유사한 상황에서 수행하는 것은 이러한 시험의 일반화가능성을 확보하기 위함으로 이해할 수 있다.

그림 1. 임상시험 단계와 시험 디자인의 내적타당도 및 외적타당도
1상 임상시험은 흔히 별도의 연구전용 병실에 피험자들을 입원시켜 시험약물 투여 후 반응을 매우 밀도있게 관찰한다. 피험자들의 입원은 시험약물의 사람에 대한 안전성 정보가 상대적으로 부족한 1상 임상시험 단계에서 피험자들의 안전을 보장한다는 측면과 함께 시험약물의 사람에의 작용을 통제된 상황에서 집중적으로 모니터링하여 시험약물의 특성을 최대한 많이 파악하기 위함이다. 이 때문에 1상 임상시험을 human pharmacology 시험이라고 하기도 한다. 이러한 디자인의 특성은 기본적으로 1상 임상시험이 탐색적(exploratory) 임상시험임을 반영한다. 즉, 1상 임상시험은 많은 경우 어떠한 가설을 검증하기 위한 시험이 아니므로 3상 임상시험 등과 같이 가설을 검증하기 위한 피험자수를 통계적으로 산출할 수는 없는 경우가 많으며, 탐색적 임상시험의 특성상 결과도 기술통계학(descriptive statistic)적으로 제시된다. 이 경우 피험자수가 커지면 제시되는 통계량의 표준오차가 줄어들어서 좀더 정밀(precise)한 결과를 제시할 수 있는 장점이 있다.
1상 임상시험은 흔히 용량을 증량(dose escalation)하여 수행한다. 이는 약물 이상반응도 기본적으로 용량 반응 관계를 따르기 때문이며 이러한 디자인을 통해 더 많은 시험약물에 대한 정보를 얻을 수 있다. 예를 들어 특정 이상반응이 용량군별로 지속적으로 나타나고 높은 용량군에서 점점 더 많이 발생한다면 이상반응이 용량-반응관계를 따르는 것으로 볼 수 있으며 이는 해당 이상반응의 시험약물과의 인과관계를 시사하는 강력한 증거이다.
1상 임상시험은 흔히 여러 용량의 시험약군과 함께 위약군을 대조군으로 두며 시험약군과 위약군에의 배정은 무작위적(random)으로 수행된다. 무작위배정은 모든 단계의 임상시험에 있어서 내적타당도를 높이기 위한 주요 수단 중 하나이다. 무작위배정은 임상시험 결과의 통계 분석의 전제조건 충족, 윤리적 문제의 경감 등과 더불어 임상시험에서 관찰하는 결과에 영향을 미치는 알려지지 않은 교란변수(unknown confounder)를 통제하는 중요한 역할을 한다. 따라서 무작위배정 여부에 따라 임상시험 결과의 증거로서의 가치에 많은 차이가 있다고 본다.
참고로 알려진 교란변수(known confounder)를 제어하는 방법으로는 층화(stratification)가 있다. 성별이 시험약물의 치료효과에 유의한 영향을 미친다면 임상시험을 성별로 나누어 일정 비율 (예를 들면 1:1)의 피험자 수로 임상시험을 수행하는 것을 예로 들 수 있다. 1상 시험 단계에서는 피험자의 안전성, 내약성 등에 영향을 미치는 인자가 일반적으로 잘 알려져 있지 않으므로 3상등 후기임상시험에서보다는 상대적으로 적게 사용된다. 하지만 UGT1A 유전형에 따라 약동학의 유의한 차이가 나고 이로 인한 독성의 차이가 알려진 세포독성 항암제인 irinotecan을 다른 항암제와 새로운 조합으로 1상 임상시험을 수행하여 최대내약용량(maximum tolerated dose)을 구할 때 UGT1A에 따라 피험자를 층화하여 1상시험을 수행하는 예도 있다.
임상시험을 수행하면 우리가 얻고자 의도하였던 signal과 함께 원하지 않은 noise도 필연적으로 발생한다. 좋은 임상시험 디자인은 signal을 증폭시키거나 noise를 줄이는 것인데 앞서 언급한 대조군, 무작위배정, 층화, 엄격한 피험자 선정기준 등은 모두 임상시험에서 noise를 줄이기 위한 방법으로 이해할 수 있으며 이는 1상 임상시험에도 적용된다.
3. 1상 임상시험의 역할 변화
신약 개발환경은 갈수록 악화되고 있다. 엄격한 신약평가에 대한 사회적 수요, 관련 규제의 강화, 판매에 성공하기 위해서는 이미 개발된 약물보다 뛰어나야 한다는 점 등에 의해 개발비용은 증가하는 반면, 신약개발을 끝까지 진행하여 신약시판 허가를 받는 약물의 개수는 오히려 감소하고 있다. 신약의 임상개발 실패 이유는 보면 2상과 3상 임상시험에서 공통적으로 치료효과의 부재가 가장 큰 원인으로 파악되고 있으며, 독성 문제가 그 다음을 따르고 있다. 아울러 3상 임상시험 단계에서의 실패율이 증가하고 있으며, 이러한 상황들은 신약개발자 입장에서는 매우 큰, 극복해야 할 문제이다.
이를 위해서 신약 개발과정에서 시험약물의 치료효과 등을 가급적 조기에 합리적, 과학적으로 파악하는 것이 매우 중요해지고 있으며 이를 위한 기술 개발이 활발하다. Phase 0 study라는 용어도 비교적 최근에 생긴 것이며 이 또한 신약의 특성을 기존보다 조기에 파악하는 것의 중요성을 말해 준다. 이러한 여건의 변화에 따라 1상 임상시험의 역할도 기존의 안전성 평가와 더불어 치료효과에 대한 파악으로 확장되고 있다. 이러한 개발 약물의 치료효과 특성에 대한 조기 파악을 가능하게 하는 것 중의 하나가 신약의 작용 기전을 반영하는 바이오마커(mechanism based biomarker) 기술이다. 과거의 신약 개발이 경험적으로 이루어졌다고 한다면 최근의 신약개발은 상대적으로 개발 초기부터 약물의 작용 기전을 파악하고 개발이 이루어진다. 따라서 1상 시험에서 이러한 기전 관련 바이오마커를 활용하여 신약이 실제로 사람에서 기전에 따라 작용하는지 여부를 관찰 (proof of mechanism, POM)할 수 있고 더 나아가 최고 치료효과 용량을 예측할 수도 있다. PET (Positron Emission Tomography)에 의한 신약의 receptor occupancy (RO)가 하나의 예이다. 즉 건강자원자나 환자에서 시험약물 투여 후 실제 시험약물의 작용부위로 제안된 수용체에 결합(RO)하는지를 관찰(POM)하고 더 나아가 RO의 용량 반응 곡선을 파악하여 최고 용량을 1상 단계에서 예측할 수 있다. POM의 의미는 전통적으로 2상 임상시험단계에서 대리표적(surrogate endpoint)의 용량반응 관계 관찰을 통한 Proof of concept (PoC)와 마찬가지로 신약이 실제로 조기 단계에서 치료효과가 있을 가능성이 높다고 판단하는 근거로 이해할 수 있다.
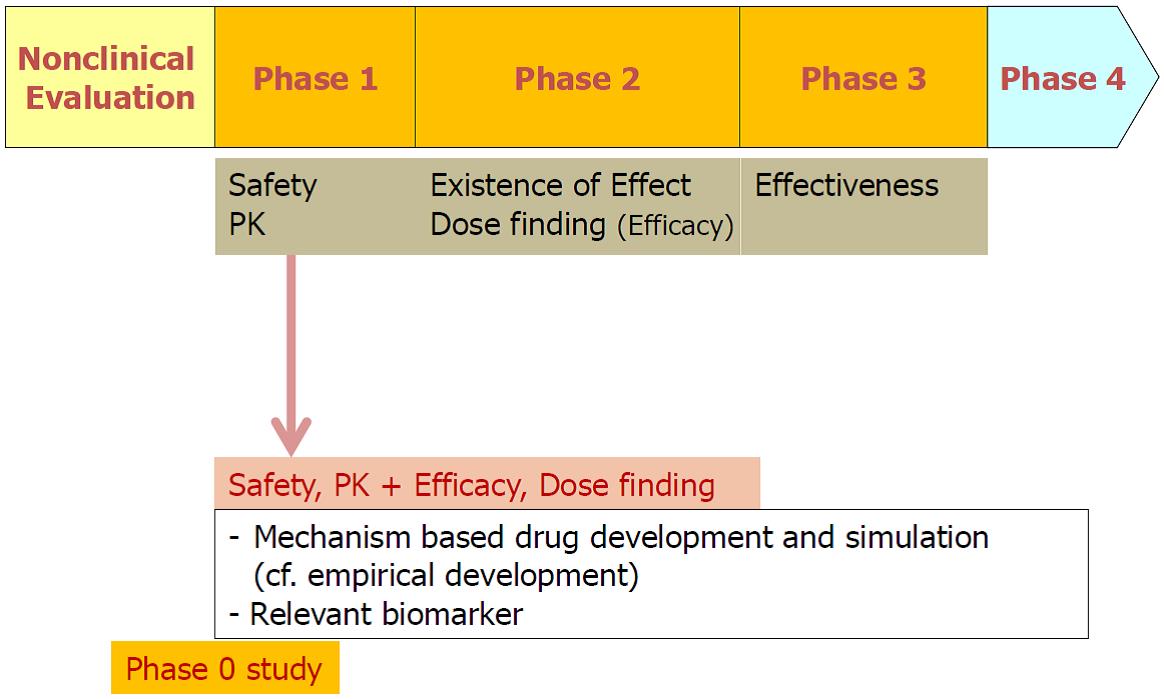
그림 2. 신약 임상평가 파라다임의 변화
신약의 조기 특성 파악은 1상 임상시험에 국한 되는 것은 아니다. 비임상 단계, 더 나아가 신약의 실험실적 개발 단계 등 좀더 빨리 파악하면 할 수록 좋다. 이를 통해 조기 단계에 go-/no go- decision을 합리적으로 수행함으로써 신약을 효율적으로 개발하고 신약개발의 기회비용을 줄일 수 있다.
신약의 조기 특성 파악과 관련하여 중요한 방법중의 하나로 인정되고 널리 활용되고 있는 것이 Pharmacokinetic (PK)-Pharmacodynamic (PD) modeling 및 system pharmacology이다. 이러한 방법은 주어진 자료에서 더욱 많은 정보를 추출해내는 informatics로 이해할 수 있으며, 여러 다양한 상황에서 활용될 수 있는 가능성이 무궁무진하기 때문에 신약개발에 있어서 핵심적 기술 중 하나로 인식되고 있어서 유수의 다국적 제약회사 등에서 활발히 활용하고 있다. 국내에서도 신약개발 초기단계에서부터 바이오마커, PK-PD modeling 기술에 대한 적극적인 관심과 적절한 활용이 필요하다.

