Review of FDA CDER Approved Drugs in 2018 (1)
유니테스CRO 조제영 대표
(본 내용은 FDA에서 발간한 New Drug Therapy Approvals in CDER, 2018의 내용을 바탕으로 작성되었다.)
현재 국내 제약사 및 벤처 기업에서는 글로벌 시장에서 통용할 만한 혁신 신약개발을 진행하고 있다. 그러나 혁신 신약 개발의 경험, 전문인력, 노하우의 측면에서 신약개발 선진국과 경쟁하기에 수준이 미흡한 실정임을 인식하고 있다. 더불어 FDA나 EMEA에서 혁신신약으로 개발된 사례를 분석하고 허가 자료의 리뷰는 경험 및 전문인력이 부족한 상황에서 노하우를 득할 수 있는 좋은 방법이라고 생각된다.
상기 보고서에서는 1) 이전에 허가된 바가 없는 최초 허가 의약품의 개발 2) 기 치료제가 있는 의약품이 유효성 및 안전성의 혁신을 보인 의약품의 개발의 리뷰 및 FDA의 bridging 역할에 대하여 리뷰함으로써 의약품의 개발에 있어 FDA를 활용하는 방법에 대하여 소개하고 있다.
2018년 FDA의 CDER 에서 허가한 의약품은 59개 이다.
Table 1. List of FDA CDER Approved Drugs in 2018
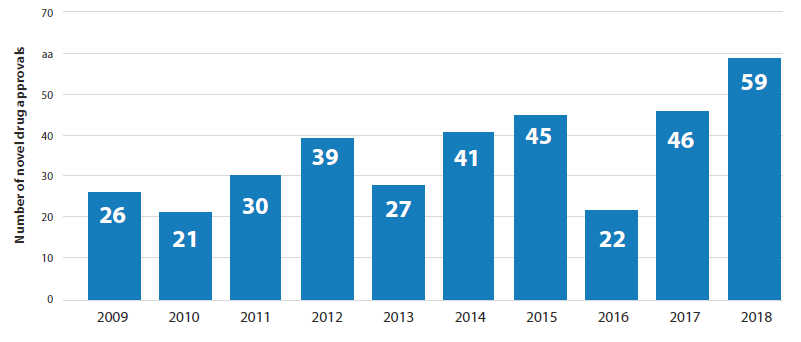
최근 10년간 CDER 가 허가한 의약품은 평균 33 개이며, 2018 년도 허가된 의약품은 전년대비 대폭 증가되었다.
Figure 1. Number of Drugs Approved from FDA CDER from 2009 through 2017
주목할 만한 것은 59개의 허가 약물 중 34개, 전체 허가 약물 중 58%에 해당하는 의약품이 희귀질환(Orphan Drug)이며 이는 지난 10년 간 허가 제품의 경향과도 유사하다.
Figure 2. List of Novel Drugs approved in 2018 with the Orphan Drugs Designation

59개의 허가 약물 중 First-In-Class의 약물은 19개로 32%에 해당하였다.
Figure 3. List of Novel Drugs approved in 2018 as First-In-Class

주목해야 할 사실은 이들 약물이 개발 및 허가 과정 중에 FDA의 Expedite Program을 적극 활용하여 허가기간까지의 기간을 단축한 점을 들 수 있다.
Figure 3. List of Drugs using Expedite Review Pathways.
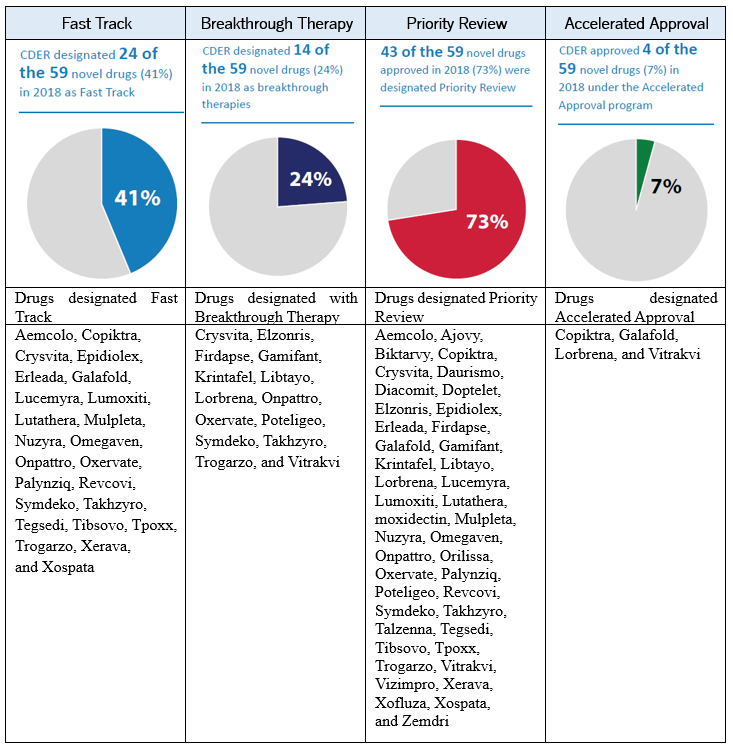
FDA expedite program은 상기와 같이 여러가지 승인 경로가 있지만 Fast Track의 경우는 약물이 어느정도 미충족 수요를 만족할 가능성이 있는가에 중점을 두며, Breakthrough Therapy의 경우 심각하거나 생명을 위협하는 질병에 있어 미충족 수요의 만족 여부 및 이들이 개발 질환에 대하여 clinical significant endpoint에 있어 향상을 보이는지, Priority Review의 경우 기존 치료법에 비해 현저한 이점이 있는지, 마지막으로 Accelerated Approval Pathway의 경우 심각하거나 생명을 위협하는 질병에 있어 현 치료 대비 임상적 유용성에 대한 진척된 부분이 있어야 한다. 이와 함께 주목해야 할 사항은 완전한 승인을 위하여 긴 치료 기간 동안의 임상적 개선점을 보여야 하나 치료제의 시급성으로 인하여 짧은 치료 기간의 종료 시점에서 임상적 개선을 “reasonably likely”하게 예측할 수 있을 때 review pathway를 통하여 조건부 승인을 받을 수 있다.
국내 글로벌 신약 개발회사는 이러한 프로그램의 적극적인 활용이 필요할 것으로 보인다.
이전
2019.11.28
다음