Review of FDA CDER Approved Drugs in 2019
(본 내용은 FDA에서 발간한 New Drug Therapy Approvals in CDER, 2019 의 내용을 바탕으로 작성되었다.)
지난 10년간 FDA의 CDER에서 허가를 받은 의약품은 꾸준히 증가해 왔다. 지난해 허가된 의약품이 59개인데 반하여 2019년도에는 48개로 그 수는 감소하였지만, 기존 치료제가 없는 질환에 대한 치료 약물이 허가되었다는 점이 주목할 만하며, 또한 국내 제약사에서 최초로 FDA로부터 승인을 득한 약물이 포함되었다는 것에 큰 의의가 있다.
본 리뷰에서는 1) 2018년 대비 2019 년도 허가 동향 및 Regulatory Pathway의 비교 및 2) FDA가 주목할 만한 제품으로 소개한 몇 개의 의약품에 대하여 리뷰 하고자 한다.
1. 2018년 대비 2019 년도 허가 동향의 비교
1) 2019 FDA의 CDER에서 허가한 의약품은 2018년 59개 대비 48개의 의약품이 허가되었다.
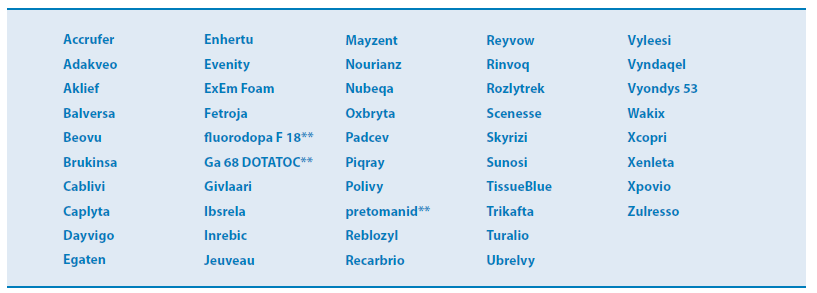
Table 1. 2019년 FDA CDER로부터 허가 받은 약물 List
2) 2018년 대비 2019년 허가 동향의 비교
최근 FDA의 허가 약물 중 Orphan Drug 및 First-in-Class 약물이 큰 비중을 차지하여 왔다. 2018년도의 경우는 Orphan Drug 과 First-in-Class 약물이 각각 58%와 32%의 비율로 Orphan Drug의 허가 비율이 높았으나, 2019년도의 경우는 두 약물의 허가 비율이 44%와 42%로 동등한 경향을 보였다.
Table 2. 2018년 대비 2019년 허가 동향 비교표
|
|
Orphan Drug |
First-in-Class |
|
2018년 |
58% (34/59) |
32% (19/59) |
|
2019년 |
44% (21/48) |
42% (20/48) |
3) 2018년 대비 2019년 허가 약물의 Approval Pathway의 비교 및 약물 List
Table 3. 2018년 대비 2019년 허가 약물의 Approval Pathway의 비교표
|
|
Fast Track |
Breakthrough Therapy |
Priority Review |
Accelerated Approval |
|
2018년 |
41% (24/59) |
24% (14/59) |
73% (43/59) |
7% (4/59) |
|
2019년 |
35% (17/48) |
27% (13/48) |
58% (28/48) |
19% (9/48) |
FDA의 허가를 목표로 할 때 허가까지 소요되는 시간과 비용의 단축을 위하여 Expedite Approval Pathway의 적절한 활용이 중요하다. 2018년 대비 2019년에는 여러 Expedite program중 Accelerated Approval의 비율이 현저히 증가되었음을 볼 수 있다. Accelerated Approval Pathway의 경우 심각하거나 생명을 위협하는 질병에 있어 현 치료 대비 임상적 유용성에 대한 이점이 있는 지와 함께 주목해야 할 사항은 완전한 승인을 위하여 긴 치료 기간 동안의 개선점을 보여야 하나 치료제의 시급성으로 인하여 짧은 치료 기간 동안의 approval endpoint가 임상적 개선을 “reasonably likely” 하게 예측할 수 있을 때 본 review pathway를 통하여 조건부 승인을 받을 수 있다. 국내 제약사 및 벤처 기업의 경우도 허가 기간까지의 단축을 위하여 Expedite Program을 충분히 활용하는 방법을 주목해야 한다.
Table 4. Expedite Program으로 허가 받은 약물 list
|
Fast Track |
Breakthrough Therapy |
Priority Review |
Accelerated Approval |
|
Cablivi Caplyta Egaten Enhertu Fetroja Nubeqa Oxbryta pretomanid Reblozyl Recarbrio Scenesse Trikafta Vyndaqel Vyondys 53 Wakix Xenleta Xpovio |
Adakveo Balversa Brukinsa Enhertu Givlaari Oxbryta Padcev Polivy Rozlytrek Trikafta Turalio Vyndaqel Zulresso |
Adakveo Balversa Brukinsa Cablivi Egaten Enhertu Fetroja Givlaari Inrebic Nubeqa Oxbryta Padcev Piqray Polivy pretomanid Reblozyl Recarbrio Rozlytrek Scenesse TissueBlue Trikafta Turalio Vyndaqel Vyondys 53 Wakix Xenleta Xpovio Zulresso |
Balversa Brukinsa Enhertu Oxbryta Padcev Polivy Rozlytrek Vyondys 53 Xpovio |
2. 2019 년도 FDA CDER 허가 약물의 소개
희귀 의약품(Rare Diseases)
2019년 희귀 의약품으로 허가를 받은 약물은 하기와 같으며, 이중 FDA가 notable한 예시로 Scenesse (afamelanotide) 와 Turalia (pexidartinib)을 소개하였다.
|
Adakveo, Brukinsa, Cablivi, Egaten, Ga 68 DOTATOC, Givlaari, Inrebic, Oxbryta, Polivy, pretomanid, Reblozyl, Rozlytrek, Scenesse, Simpso, TissuBlue, Trikafta, Turalio, Vyndaqel, Vyondys53, Wakix, Xpovio |
■ Scenesse
치료 적응증
Erythropoietic protoporphyria (EPP)는 heme을 생성하는 ferrochelatase효소의 활성을 저해하는 유전자 mutation에 의하여 유발되는 질환이다. Scenesse는 짧은 light의 노출에 의해서도 심한 피부 통증을 느끼는 EPP 환자를 대상으로 최초로 systemic photoprotective drug으로 허가된 의약품으로, 환자에게 pain-free light exposure를 증가시킨다.
작용 기전
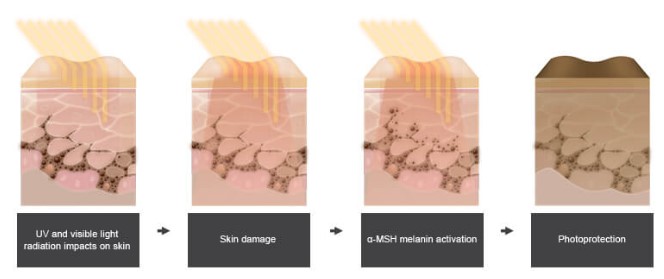
Scenesse는 synthetic tridecapeptide (13 amino acid의 linear peptide) α-melanocyte stimulating hormon (α-MSH) analog 로 melanocortin receptor agonist 로 MCI-R에 binding하여 photo-protective agent로 알려진 melanin을 증가시키는 기전으로 UV radiation에 의한 피부 손상을 보호하는 기전으로 작용하는 약물이다. α-MSH는 UV radiation에 의하여 melanocyte (Langerhans cells)에서 release되어 blood system을 통하여 다른 skin cell의 melanocytes에서 melanin 생성을 촉진시켜 UV에 의한 피부손상을 방어하기에 짧은 반감기를 가지고 있다. Scenesse는 13개의 amino acid 중 2개의 amino acid의 변화로 skin protective 효과를 가진 melanin의 생성을 증가시켜 UV radiation에 의한 피부 손상을 보호한다.
Figure 1. Scenesse의 UV light에 의한 피부손상 보호 기전
Proof of Concept 임상 연구
Scenesse의 효능은 20개의 clinical trials 중 2개의 중요 연구를 통하여 확인되었다. EPP환자를 대상으로 placebo 대비 Sceness를 2달에 한번 subcutaneous implant로 180일 동안 10am에서 6pm사이 직접적인 햇빛에 노출 시 placebo 41시간 대비 Scenesse 투여 군에서는 통증 없이 노출 가능한 시간을 64시간으로 증가시키는 것으로 확인되었으며, 다른 clinical trial을 통하여 10am에서 3pm까지 outdoor activity를 수행하면서 직사광선에 노출되었을 때 placebo군의 경우 0.75 시간 대비 Scenesse 투여 환자 군에서 총 6시간 동안 통증없이 활동이 가능한 개선을 보여주었다.
중요 side effects
Scenesse 투여에 의한 중요 side effects로는 implant site reaction, nausea, oropharyngeal pain, cough, fatigue, skin hyperpigmentation, dizziness, melanocytic nevus, respiratory tract infection, somnolesce (feeling drowsy), non-acute porphyria 및 skin irritation으로 확인되었다.
Regulatory Approval Pathway
Sceness는 Orphan Drug designation을 득하고 Priority Review Designation을 통하여 허가되었다.
■ Turalio
치료 적응증
Joint 부분에 tenosynovial giant cell tumor (non-cancerous)이 자라 수술적 치료로 개선되지 않는 환자를 대상으로 부종, 통증 및 joint 기능저하를 개선시킨다.
Proof of Concept 임상 연구
임상적 유용성을 검증한 임상에서 총 120명이 등록되어 overall response rate (ORR)를 1차 유효성 평가 변수로 25주간 placebo군의 no response 대비 Turlio를 투여 받은 환자 군에서 ORR이 38% 로 통계적 유의성을 확인하였다. Complete response rate와 partial response rate는 각각 15% 및 23% 였다. 또한 Response maintenance를 follow up 한 결과 23명의 Responder 중 22명에 해당하는 환자에서 6개월 이상 유지가 됨을 확인하였으며, 13 responder 에서는 총 12개월 이상 유지됨을 확인하였다.
본 허가 약물은 허가 시 liver injury에 대한 Boxed Warning을 받은 약물로, 본 약물은 처방전 liver test를 통하여 약물 치료 여부를 확인하여야 한다. 약물의 개발단계에서 liver damage의 potential이 있는 약물은 개발 과정에서 그만큼 추가적으로 진행하여야 할 임상 연구와 허가 기관과의 조율이 필요하다. 더불어 본 허가 약물의 허가 자료의 Review는 임상적 유용성은 있으나 liver injury의 potential이 있는 약물의 연구 범위를 참조하는데 최근 허가를 득한 약물 중 좋은 예시로 보여진다.
중요 side effects
본 의약품에 의한 common side effects로는 liver injury, hair color changes 및 tiredness로 확인되었다.
Regulatory Approval Pathway
Turlio는 Orphan Drug Designation을 득하고 Breakthrough Therapy 및 Priority Review를 통하여 허가되었다.
이어지는 리뷰에서는 First-in-Class 로 허가 받은 notable 한 약물의 소개 및 2119년도에 FDA CDER 로 부터 허가를 득한 약물의 전반적인 리뷰를 진행하고자 한다.
이전
다음
2020.03.24