2022년 상반기 FDA 승인 현황
국가신약개발사업단 기획운영팀 곽서연 선임연구원
Overview
2022년 상반기
미국 식품의약국(FDA)은 총 16건의 신약을 승인하였다. 이 중 NME(New Molecular Entity, 신규 물질
허가)가 12건, BLA(Biologics
License Applications, 생물의약품 허가)는 4건이었다. 지난 2021년
한 해 동안 FDA가 승인한 신약 50건 중 27건이 상반기에 승인된 것을 고려하였을 때, 올해 FDA 승인을 받을 신약의 수는 대폭 감소할 것으로 보인다. 그뿐만
아니라, 현재의 추세라면 최근 5년 동안 가장 적은 수의
신약이 승인되는 해가 될 확률 또한 높다.
다만 올해 상반기 승인된 신약들의 향후 시장 잠재력은 높은
상황이다. 네이처 리뷰 드럭 디스커버리(Nature Review
Drug Discovery)에 따르면, 올해 상반기 승인이 이루어진 제품 중 2028년에 연 매출 10억 달러 이상을 기록할 것으로 예상되는 예비
블록버스터 신약은 전체의 31%인 5개였다. 2028년, 제2형 당뇨
치료제 Mounjaro(Eli Lilly)의 예상 매출액은 81억
달러이며, 아밀로이드 트랜스티레틴 아밀로이드 다발신경병증(AATR-PN)
RNAi 치료제 Amvuttra(Alnylam)의 예상 매출액은 27억 달러이다. 신생혈관성 또는 습식 노인성 황반변성(nAMD/wAMD) 및 당뇨병성 황반부종(DME) 이중항체 치료제
Vabysmo(Roche)의 2028년 매출액은 18억 달러, 폐쇄성 비후성 심근병증 치료제 Camzyos(BMS)는 17억 달러로 예상된다. 불면증 치료제 Quviviq(Idorsia)는 10.5억의 매출액이 예상된다.
Bristol Myers Squibb(BMS)가 유일하게 2022년 상반기동안 Opdualag와 Camzyos로 2건의 신약승인을 받았다. 진행성 흑색종 1차 치료제로서 최초의 LAG-3 차단 항체 복합제인 Opdualag는 LAG-3 항체 Relatlimab과 Opdivo의 고정용량 병용요법이다. Opdualag는 올해 7월 EMA(유럽의약품기구) 자문위원회에서도 허가권고를 받아 더 많은 흑색종 환자들에게 넓은 선택권을 제공할 할 수 있게 되었다. 또한 Opdualag는 용량 특허를 통해 2028년 특허가 만료될 예정인 Opdivo의 수명을 20년 늘리는 에버그리닝(Evergreening) 특허전략으로 업계의 눈길을 끌었다. 또 다른 승인 신약인 경구용 심장질환 치료제인 Camzyos는 희귀질환인 폐쇄성 비후성 심근증(HCM)의 근원적인 병태생리를 표적으로 하고 심장 미오신을 타겟하여 저해하는 최초의 의약품으로, 2028년 예상 매출액은 17억 달러(한화 2조 2270억원)로 예측된다.
스위스 기반의 회사 Idorsia는 올해 처음으로 FDA 승인 신약을 보유하게 되었다. Idorsia는 뇌를 진정시키는 기존의 진정제 계열의 수면제와 다른 새로운 기전의 불면증 치료제인 Quviviq를 개발하였다. Quviviq은 이중 Orexin 수용체 길항제로써 각성을 촉진하는 신경전달물질인 Orexin을
차단하여 과도한 각성 상태를 약화시키는 기전으로 불면증을 치료하는데, 기존의 진정제 계열의 수면제에
비해 낮 시간 졸음 등의 생활 불편을 감소시켰다. Quviviq의
2028년 예상 매출액은 11억 달러(한화 1조 4410억 원)로
예상된다.
희귀질환 치료제들의 승인은
순조로운 편이다. 상반기에 승인된 신약의 절반인 8건이 희귀질환
치료제(Orphan Drug Designation)이며, 그
중에서 포도막 흑색종 치료제 Kimmtrack(Immunocore)와 희귀 혈액질환인 한랭응집소증 치료제
Enjaymo(Sanofi), 용혈성 빈혈 치료제
Pyrukynd(Agios), CDKL5 결핍장애 치료제 Ztalmy(Marinus), HCM 치료제 Camzyos(Mycovia), AATR-PN 치료제 Amvuttra(Alnylam)
6건은 해당 질환의 최초 희귀질환 치료제이다. FDA는 앞으로도 희귀질환 치료제 개발을
지원하는데 지속적인 노력을 투자할 것으로 보인다. 이 외에도 희귀질환은 아니지만 재발성 외음부 칸디다증에
대한 최초의 의약품인 Vivjoa(Mycovia) 또한 올해 상반기 FDA의
승인을 받았다.
|
|
승인일 |
제약사 |
제품명 |
성분명 |
모델리티 |
작용기전 |
질환분야 |
적응증 |
2028년 예상매출 (USD) |
|
1 |
1/10 |
Idorsia |
Quviviq |
Daridorexant |
Small molecules |
Orexin 1 receptor/2 (OX1R/OX2R)
antagonist |
Neurology |
불면증 |
1.1 billion |
|
2 |
1/14 |
Pfizer |
Cibinqo |
Abrocitinib |
Small molecules |
JAK-1 inhibitor |
Dermatology |
아토피 피부염 |
760 million |
|
3 |
1/25 |
Immunocore |
Kimmtrak |
Tebentafusp |
Protein |
Gp100-targeted TCR fused to CD3 binding
Fab |
Oncology |
포도막 흑색종 |
185 million |
|
4 |
1/28 |
Roche |
Vabysmo |
Faricimab-svoa |
Antibody |
ANG2 x VEGF bispecific antibody |
Ophthalmology |
노인성 황반변성, 당뇨병성 황반부종 |
1.8 billion |
|
5 |
2/4 |
Sanofi |
Enjaymo |
Sutimlimab-jome |
Antibody |
C1S targeted antibody |
Hematology |
한랭응집소증 |
436 million |
|
6 |
2/17 |
Agios |
Pyrukynd |
Mitapivat |
Small molecules |
Pyruvate kinase isoenzyme R(PKR)
activator |
Hematology |
용혈성 빈혈 |
511 million |
|
7 |
3/1 |
CTI Biopharma |
Vonjo |
Pacritinib |
Small molecules |
JAK-2, FLT3 inhibitor |
Hematology |
골수 섬유화증 |
496 million |
|
8 |
3/18 |
Marinus |
Ztalmy |
Ganaxolone |
Small molecules |
GABA A receptor modulator |
Neurology |
CDKL5 결핍장애 |
434 million |
|
9 |
3/18 |
BMS |
Opdualag |
Nivolumab + Relatlimab-rmbw |
Antibody |
LAG-3 targeted antibody |
Oncology |
흑색종 |
N/A |
|
10 |
3/23 |
Novartis |
Pluvicto |
Lutetium(177Lu) vipivotide tetraxetan |
Others |
PSMA-targeted radioligand therapy |
Oncology |
양성 전이성 거제저항성 전립선암 |
851 million |
|
11 |
4/26 |
Mycovia |
Vivjoa |
Oteseconazole |
Small molecules |
fundal CYP51 inhibitor |
Infectious |
외음부 칸디다증 |
N/A |
|
12 |
4/28 |
BMS |
Camzyos |
Mavacamten |
Small molecules |
Myosin inhibitor |
Cardiovascular |
폐쇄성 비후성 심근병증 |
1.7 billion |
|
13 |
5/3 |
Phathom |
Voquezna |
Vonoprazan, Amoxicillin (+Clarithromycin) |
Small molecules |
50S RNA, PBP, H+/K ATPase pump inhibitor |
Infectious |
헬리코박터 파일로리 |
869 million |
|
14 |
5/13 |
Eli Lilly |
Mounjaro |
Tirzepatide |
Small molecules |
GLP-1, GIP co-agonist peptide |
Metabolic |
당뇨병 |
8.1 billion |
|
15 |
5/23 |
Dermavant |
Vtama |
Tapinarof |
Small molecules |
Aryl hydrocarbon receptor(AHR) modulator |
Immunology |
건선 |
N/A |
|
16 |
6/12 |
Alnylam |
Amvuttra |
Vutrisiran |
RNA |
Transthyretin-targeted siRNA |
Metabolic |
아밀로이드 트랜스티레틴 아밀로이드증 다발신경병증 |
2.7 billion |
[표 1. 2022년 상반기 FDA 승인 현황]
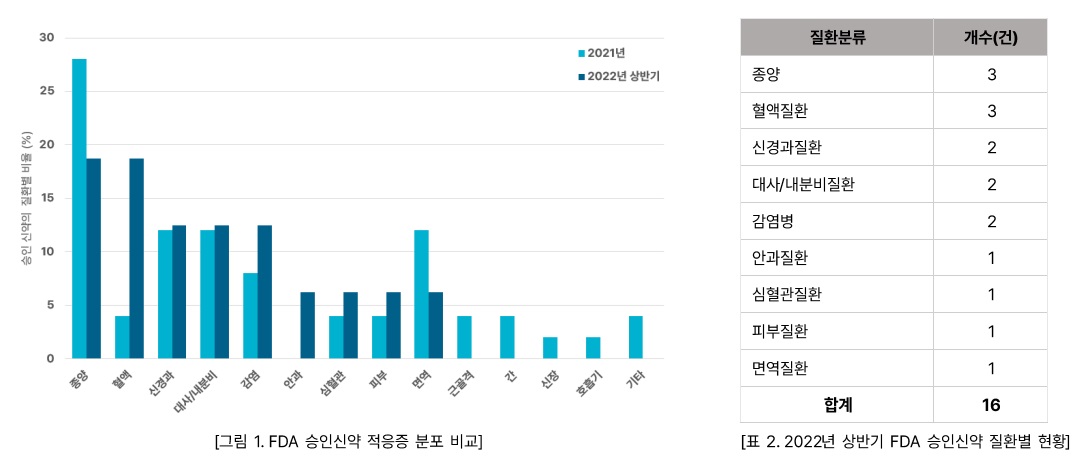
1. 적응증 분포
적응증 분야별로 보면 신약의 가장 큰 비율을 차지한 분야는 종양과 혈액질환으로, 각각 전체의 19%를 차지하였다.
종양의 경우 지난해 전체의 28%를 차지하였던 것과 비교하여 크게 감소하였다. 반면 혈액질환은 전체의 5%를 차지하였던 작년과 비교하여 크게 증가하였다. 이외에도 신경과질환, 대사/내분비질환, 감염병이 13%로 뒤를 이었다. 신경과질환과
대사/내분비질환의 경우 작년과 비슷한 수치를 보였으며, 감염질환의
경우 작년(8%)과 비교하여 증가하였다. 다만 2022년 상반기에는 전체 승인 수가 작년에 비해 큰 폭으로 감소하였기 때문에 데이터 해석에 주의가 필요하다.
(이번 질환분류는 BioCentury의 BCIQ
database에 기반하여 진행된 것으로 Nature Review Drug Discovery의
분류와 다소 차이가 있다.)
2. 모달리티 분포
2022년 상반기 승인을 받은 신약의 물질 분포는 지난해와 비슷한 것으로 나타났다. 2022년
상반기에 NME(신규 물질 허가)는 12건으로 전체의 75%를 차지하며 작년(72%)에 비해 소폭 증가하였다. NME는 저분자 의약품이 11건으로 가장 많았으며, 여기에는 10건의
비펩타이드성 저분자 의약품과 1건의 방사선 리간드 의약품으로 구분된다.
그 외에 올리고 뉴클레오타이드에 속하는 RNA 치료제 1건도
허가를 받았다. BLA(생물의약품 허가)의 경우, 2022년 상반기에 허가를 받은 4건은 모두 단백질 의약품으로, 항체가 3건, 재조합
단백질 의약품이 1건이었다.

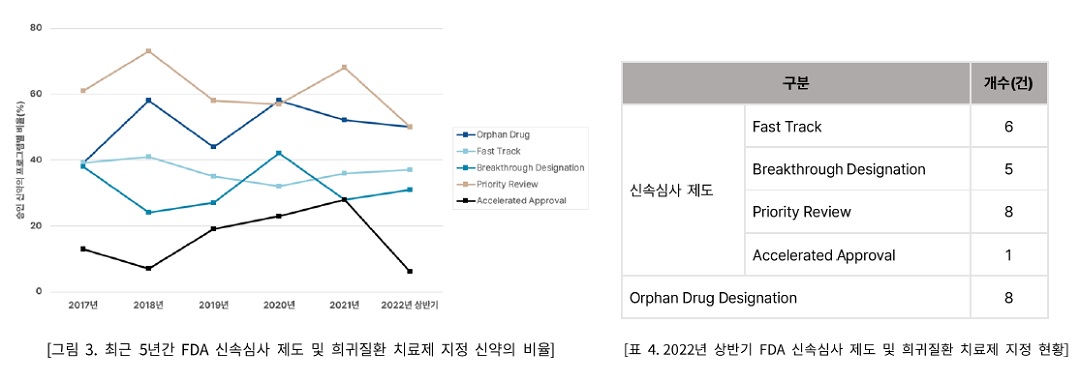
3. FDA 신속심사제도 및 희귀질환 치료제 지정 신약
FDA에서는 심각하고 위험한 질병의 치료제들을 빠른 시간 안에 개발해
환자들에게 제공하기 위해 4개의 신속심사 제도를 운영하고 있으며, 이는
Fast Track(신속심사), Breakthrough
Designation(획기적 치료제), Priority Review(우선심사), Accelerated Approval(가속승인)로 분류된다. 신속심사제도 및 희귀질환 지정은 중복 지정이 가능하며, 2022년
상반기 FDA 승인 신약 중 최소 1개의 지정을 받은 신약은 13개로 전체의 81.2%였다. 최근
5년간의 트렌드와 비슷한 수준인 Fast track과 Breakthrough Designation과 달리, Accelerated Approval는
전년도대비 급격히 감소하여 최근 5년 중 최저치인 6%를
기록하였다. Priority Review 또한 전년도 대비 크게 감소하여 최근 5년 중 가장 낮은 분포율인 50%를 기록했다.
Orphan Drug Designation(희귀질환 치료제)은 해당 질환의 환자 수가 적고 미충족 의료수요가 높은 의약품을 대상으로 진행되는 제도로서, 의약품 품목허가신청(NDA)와 직접적인 연관성은 없으나 연구개발
비용의 세액 공제 및 시장독점권 등의 혜택이 있다. FDA가 희귀질환 치료제 개발 지원을 위해 지속적으로
노력하는 만큼 Orphan Drug Designation은 2020년부터
꾸준히 전체 승인 신약의 50%대를 유지하고 있다.
4. CBER 승인 백신 및 유전자/세포치료제
위의 집계에 포함되지 않은 생물의약품 평가연구센터(CBER) 승인 신약도 3건 있었다. 백신 및 유전자/세포치료제 등의 의약품은 FDA 약물평가연구센터(CDER)가 아닌 CBER 승인을 거친다. 2022년 상반기에는 Moderna의 코로나19 백신 Spikevax와 다발성 골수종을 적응증으로 한 두번째 CAR-T 치료제인 Carvykti(J&J/Legend), GSK의 MMR백신 Priorix 총 3건이 CBER의 승인을 받았다.
2022년 가장 먼저 CBER의
승인을 받은 것은 코로나19 백신인 Spikevax(Moderna)였다. Spikevax는 2020년 12월
FDA로부터 18세 이상 개인에 대한 긴급 사용허가를 받아
접종이 되어왔는데 지난 1월에 완전 승인을 받으며 미국에서 FDA 승인을
받은 두 번째 코로나19 백신이 되었다. 첫번째 코로나19 백신은 지난 해 8월 16세
이상에서 완전 승인을 받은 Comirnaty(Pfizer&BioNTech)였다. 이어서 CBER의 승인을 받은 Carvykti(J&J/Legend)는
BCMA CAR-T 치료제로, 1년 앞서 출시된 최초의 BCMA CAR-T 치료제 Abecma(BMS)보다 장기 효능데이터에서
더 우수하다는 평가를 받으며 많은 주목을 받고 있다. 마지막으로 지난 6월 MMR백신
Priorix(GSK)가 CBER 승인을 받았다. FDA승인을
받기 전까지 미국은 1971년에 승인된 MMR II(MSD)가 MMR 백신 시장을 독점하고 있었으나, 이번 승인으로 인해 미국에서도
Priorix 사용이 가능해졌다. Priorix는 1997년 독일에서 승인된 이후 유럽 전역을 포함해 전 세계 100개
이상의 국가에서 출시되었다.
|
|
승인일 |
제약사 |
제품명 |
성분명 |
모델리티 |
질환분야 |
적응증 |
|
1 |
1/31 |
Moderna |
Spikevax |
Elasomeran mRNA vaccine |
백신 |
Infectious |
Covid-19 |
|
2 |
2/28 |
J&J/Legend |
Carvykti |
Ciltacabtagene autoleucel |
세포치료제 |
Oncology |
3L+ 다발성 골수종 |
|
3 |
6/6 |
GSK |
Priorix |
Measles-Mumps-Rubella vaccine |
백신 |
Infectious |
홍역, 유행성이하선염,
풍진 |
[표 5. 2022년 상반기 CBER 승인
백신 및 유전자/세포치료제]
<문의>
국가신약개발사업단
기획운영팀 곽서연 선임연구원 (seokwak@kddf.org)
Reference
FDA,
Novel Drug Approvals for 2022
5 FDA
decisions to watch in the third quarter
https://www.biopharmadive.com/news/5-fda-approval-decisions-third-quarter-2022/625983/
FDA
new drug approvals in Q1 2022
https://www.nature.com/articles/d41573-022-00063-9
FDA
new drug approvals in Q2 2022
https://www.nature.com/articles/d41573-022-00123-0
The
biggest launches of 2022: a reboot, Evaluate
Vantage
https://www.evaluate.com/vantage/articles/insights/nme-approvals/biggest-launches-2022-reboot
이전
2022.08.16
다음
2022.09.14