글로벌 신약개발 패러다임의 진화 – ‘Translational R&D’
남 수 연 MD, Ph. D., 유한양행 R & D 상무
혁신적인 신약 개발은 다른 R&D 분야와 달리 10년 이상 장기간의 천문학적인 경제적 투자와 고도로 숙련된 다방면의 전문 인력이 요구되는, 지적 자원 및 경제집약적
R&D 사업이다. 이러한 장기간 고비용 투자에도 불구하고 실제로 신약으로 허가되어 블록버스터급 신약으로 사업화에 성공하는 경우는 10%미만에 불과하다. 불행히도 이런 경향은 최근 10년 사이에 더욱 심화되는 추세로, 글로벌 제약사
R&D 현장에서는 신약개발의 생산성을 높이기 위한 노력의 일환으로 Translational
R&D를 신약개발의 새로운 패러다임으로 적극적으로 도입 활용하고 있다.
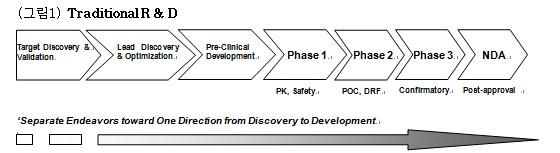
전통적인 신약개발과정은 각각의 연구개발단계가 서로 단절된 상태에서 실제로 개발되는 신약이 현재 표준치료법에 비해 어떤 환자에서 어떠한 상대적 임상적 장/단점을 제공할 수 있는지, 또한 등록허가 및 사업화 전략에 대한 총체적이고 유기적인 연구개발의 전략적 지도 없이 각 단계에서 임의로 연구를 진행하고 다음단계로 이행되는 형태이다. (그림 1 참조) 이러한 단절과 비유기적인 전임상 연구의 결과는, 임상개발에 그대로 적용되지 못하거나, 유효성 및 안전성을 증명하는 임상개발에 실패하는 경우가 발생하고, 혹은 임상 개발에 성공했다 할지라도 unmet medical needs를 충족하지 못하는 시장성이 없는 약으로 개발되는 결과가 초래되곤 하였다.
(그림1) Traditional
R&D
이에 반해 Translational
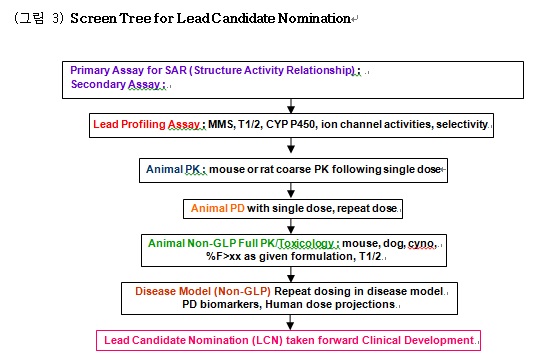
R&D 의 기본 개념은 과학의 진보와 신기술의 개발 등이 실제로 신약 개발과정에 적용되며 (bench to bedside translation), 또한 임상경험, 임상실험의 결과분석에 의해 밝혀진 질병병인의 이질성과 약물반응의 다양성을 보이는 환자의 특성 등의 기전을 연구하여 (bed to bench backward translation) 그 결과를 다시 신약개발에 응용하는 양방향 (bidirectional) 연구라 하겠다.(그림 2 참조) 또한 신규표적에 대한 임상적 목표 프로파일 (Clinical target product profile)을 수립한 후 이를 성취할 수 있도록 각각의 연구 개발단계가 서로 유기적이고 통합적으로 연결되어 이전 단계의 결과가 다음 단계에 효율적으로 적용 (translation) 될 수 있는 연구 개발 계획 (Screen Tree)를
(그림2) Paradigm Shift toward Translational
R&D

연구개발 시점에 작성하여 진행함으로 신약 개발의 성공확률을 향상시키는 접근법이라 하겠다. (그림 3 참조) 이 과정에서 중요한 원칙들 중 첫 번째는 실시간으로 정보를 공유 및 적용하는 것 인데, 이는 연구개발 단계에서 관찰된 결과를 실시간으로 분석 및 해석하여 연구 개발과정에 즉각적으로 반영 (translation)하여 연구 개발 계획 및 방법을 실시간으로 수정함으로 시간 및 비용을 최소화 할 수 있다는 것이다. 이러한 실시간 결과에 따라 수정이 가능하도록 하는 Adaptive Clinical Protocol 개발이 필수적이다. 두 번째 원칙은 확증적 3상 임상시험에서 Target Product Profile을 성취 할 수 있도록 하는, 잘 예측할 수 있는 생체지표인자 (biomarker)들을 전임상 및 조기 임상에서 탐색하고 검증하여야 한다는 것이다. 글로벌 신약의 허가를 위한 대부분의 3상 임상시험은 최소한 3-5년의 시간과 수천억 원의 규모의 투자를 요구하기 때문에, 조기 임상 즉 2상 (Proof of Concept study) 의 결과를 토대로 Go/No-Go 결정을 하게 된다. 일반적으로 2상 임상시험은 적은 수의 환자들을 대상으로 단기간의 치료 결과를 얻음으로, 3상 임상시험에서 확증할 치료 용량의 설정과, 아주 제한적인 유효성 및 안전성 평가를 목적으로 한다. 이러한 제한적 임상 평가 하에서 Go/No-Go 결정을 하기 위해서는 궁극적인 허가요건인 임상적 유효성과 안전성을 되도록 정확하게 예측해줄 수 있는 생체 인자들의 활용이 절대적으로 중요하게 된다. 이러한 생체 지표인자들의 탐색과 검증은 연구 개발 초기 단계부터 이루어져야 하며, 적절한 질환동물모델에서 잘 검증된 생체인자를 이용하여 초기 임상시험 (1상 및 2상) 에서 관찰한 PK-PD (Pharmacokinetic-Pharmacodynamic) Relationship은 Modeling & Simulation 을 통해서 3상 임상에서 평가할 치료용량을 설정하는 데도 중추적 역할을 하게 된다. 이와 같이 임상에서 활용될 수 있는 생체지표가 대상 환자의 치료효과를 잘 반영(Translation) 해 주는 질환동물 모델에서의 반응 정도와 잘 연관되어 있다면, 이러한 예측인자는 전임상 (Laboratory)과 임상(Clinic)을 효과적으로 연결해주는 가교(bridge the gap)가 된다고 하겠다.
이러한 과정에서 혁신적이고(innovative), 유연한(flexible), 적응적(adaptive) 임상시험 디자인은 임상개발시간을 효과적으로 단축시켜줄 뿐 아니라, 생체지표의 활용 및 실시간 결과 분석을 통해 Dose-PK-PD Relationship을 비용-효율적으로 얻을 수 있도록 해준다.
90%이상의 신약개발 노력이 실패로 끝나고 마는 어렵고 힘든
R&D 현장에서 효율성과 생산성 향상이 절대적으로 요구되는 현실과, 진화하고 있는 글로벌 제약사들의 신약개발 패러다임하에서 경쟁해야 하는 국내 제약 R & D의 앞길은 험난함 그 자체이다. 하지만 우리에게 주어진 제한된 자원과 시간의 싸움에서 승리하는 길은 제약사 연구소뿐 아니라 정부 및 사학 연구소, 정부유관 부서와 연구자 등이 상호 유기적인 협력을 통해 Translational
R&D를 적극적으로 활용하여 총체적이고 조직적인 연구 개발 전략을 수립해 시간-/비용-효율적으로 수행해 나가는 것이라 생각된다.


