범부처신약개발사업단 신상훈 경영지원 팀장
(a) 진단법
이 결과는 그 후에 방사성 지표가 아닌 형광성 지표를 가진 기질을 활용한 간단한 시험법으로 개발되어 현재까지 (1) 환자진단, (2) 대부분의 보인자(保因者: genetic carrier) 판명, 그리고 (3) 출생 전 진단에 사용되고 있다. 필요 시 유전형 판독법 (genotyping)은 이형접합체 (heterozygote)의 판명을 위하여 활용된다.
(b) 효소 대체술의 초창기 연구
고셔 병의 원인이 효소결핍에 기인하는 점이 밝혀진 후, 효소 대체술이 환자에게 도움이 되리라 가정하고, 기본적인 단백질 정제를 통해 활성과 분획에 필요한 최적조건들을 알게 되었는데 그 결과는 효소활성의 적정 pH는 6.0이고 리소좀(lysosome)에서 최고로 활성이 높았다.
임상시험에 필요한 효소를 분리할 인체 원재료를 찾다가 결국엔 인체 태반을 활용하게 되었다. 태반에서 정제된 효소인 Glc-Cer’ase를 정맥 내로 주입한 후 그 전후에 피부를 관통하여 간을 바늘 생검 (percutaneous needle biopsy of liver)하여, 그 결과를 반복적으로 정밀분석한 결과 Glc-Cer의 혈중농도가 정상치의 4배 이상 수준이었다가 주입 후 72시간에 걸쳐서 정상치로 내려가는 것을 확인하였다. 중요하게도 몇 주간에 걸쳐서 그 수치가 정상치를 유지하였고 천천히 다시 증가함을 보여 주었다
(c) 태반에서 Glc-Cer’ase의 대량정제
정제공정을 대량생산화 하기 위해서 Glc-Cer’ase의 소수성 (hydrophobicity)를 이용하여 단백질에 붙어있는 지질을 부탄올로 분획하는 공정을 추가하여 가능하여 졌다. 당시에 진행된 한 명의 고셔 환자 임상시험은 성공적이지 않았는데 그 이유는 충분하지 않은 Glc-Cer’ase 때문이라고 해석되었다
(d) 지방저장세포로의 Glc-Cer’ase의 표적화
일곱 명의 환자에게 새로운 Glc-Cer’ase를 주입하였는데, 세 명은 간에서 Glc-Cer가 감소하였고, 나머지 네 명은 변화가 없었다. Glc-Cer’ase가 시험관에서는 왕성한 활성이 있었는데도 불구하고 나온 이 결과를 쉽게 설명하기 어려웠다. 시간이 지나서야, 정제된 Glc-Cer’ase의 대부분이 실험동물의 간에 있는 간세포 (hepatocyte)에서 흡수되어 버리는 것을 알게 되었다. 하지만 간에서 대부분의 Glc-Cer가 축적되는 곳은 대식세포(macrophage, Kupffer세포)이기 때문에 이렇게 주입된 효소가 엉뚱하게도 간세포로 흡수되어 낭비되어 버리는 것은 전혀 원치 않던 일이었다. 또한 이 효소를 부탄올로 분획하는 공정에서 인산화세린(phosphatidylserine)이 제거되었는데 이 물질은 효소를 활성화 시킬 뿐만 아니라 대식세포에 단백질 등을 전달할 수 도 있다는 것이 밝혀 졌다.
이 시점에서 두 가지 사실을 알게 되었는데, (1) 리소좀 효소들은 당단백질이라는 것과 (2)대식세포는 만노스 (mannose) 말단 (terminal)을 가진 당복합체(glycoconjugate)에 대하여 강력한 결합력을 가진 렉틴 (lectin: 당결합 단백질)을 가지고 있다는 것이다.
Glc-Cer’ase는 네 개의 올리고당 곁가지 (oligosaccharide side chain)를 가지고 있다. 그 중 세가지는 복합형인데 그 말단(terminal)은 N-아세틸 뉴라미닉산(N-acetyneuraminic acid, NANA, sialic 산의 일종)이나 또는 갈락토오스(galactose)로 되어 있다. 당단백질에서 NANA가 분해되고 갈락토오스가 노출되기 시작하면 (asialo-, 시알산이 분리된상태) 특이한 피해를 가져다 주는데 그 이유는 간세포(hepatocyte)가 이 갈락토오스에 결합하는 아주 강력한 렉틴*(asialoglycoprotein 수용체 또는 발견한 미국 국립의료원(NIDDK)의 애쉬웰 박사 [Gil Ashwell]의 이름을 따서 애쉬웰 수용체라고도 불림)을 가지고 있기 때문이다.
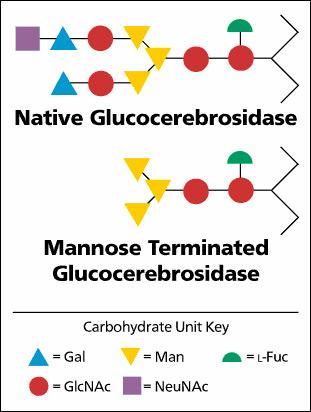
간세포에서 대식세포로 Glc-Cer’ase 효소를 전환시키기 위하여 세가지 실험을 하였다. (1) 선형으로 만노스 다섯 개를 곁가지로 만들어 효소에 공유결합시켜 보았는데, 결과는 대식세포로 표적화되지 않았다. (2) 라이신 두개와 만노스 세 개를 (dilysyltrimannosyl residue) 단백질에 공유결합시켜 보았는데, 대식세포로 단백질이 네 배정도 증가하여 흡수되는 것이 보였다. (3) 충분하다고 보이지 않아서, 효소에 있는 올리공당 곁가지 복합체로부터 3개의 말단 올리고당을 특이적으로 절단할 수 있는 외부당 절단효소 (exoglycosidase)를 가지고 제거하여 더 이상 갈락토오스가 존재하지 않고 만노스 말단 (mannose terminal, 이하 MT-)을 가진 효소를 생산할 수 있었다. 이런 MT-효소는 더 이상 애쉬웰 수용체에 결합하지 않기 때문인데, 이 전략은 기존 효소 대비 쿠퍼세포 (Kupffer cell)에서 획기적으로 50배 이상의 증가된 흡수를 가져올 수 있었다.
(e) MT- Glc-Cer’ase (mannose terminal Glc-Cer’ase, MT-Glc-Cer’ase)를 활용한 초기 임상연구
고셔 병을 일으키는 지방산이 저장되어 있는 쿠퍼 세포로의 전달력이 월등하게 향상된 효소가 구해지게 되자, 1형 (비신경증) 고셔 병 7명의 성인과 한 어린이에게 6개월간 주간 190 unit의 MT- Glc-Cer’ase를 투약하는 임상시험을 수행하였다. 이중에서 5세 남아인 어린이만이 확연한 반응을 보였다. 효소주입을 시작한지 5~6주가 지나자 빈혈상태에 있던 헤모글로빈 수치가 증가하기 시작하였다. 추가하여서는 심각하게 낮은 수치였던 혈소판도 점차적으로 증가하기 시작하였다. 이 어린이 환자는 매주 체중대비 13 unit kg -1 를 투약 받은 반면, 성인 환자들은 체중대비 2 unit kg -1 을 투약 받았다. 이런 효과가 이 어린이 환자의 비정상적인 혈액학적 상태가 저절로 회복되어서 생긴 것이 아닌지 확인하기 위하여 효소투약을 중지하여 보았다. 헤모글로빈과 혈소판 수치 모두 점차적으로 감소하여 효소주사를 맞기 전 상태로 돌아가 버렸다. 그런 후에 이 환자에게 체중대비 32 unit kg -1 의 매주 Glc-Cer’ase를 투약하기 시작하자, 그의 헤모글로빈과 혈소판 수치는 빠르게 정상수치로 회복되었다. 그 이후로 이 환자는 Glc-Cer’ase를 격주간으로 주입 받고 있으며, 그의 수치들은 그 이후로는 계속 정상수치를 유지하고 있다. 혈액학적 반응뿐만 아니라, 그 환자의 엄청나게 비대해졌던 비장과 간은 정상적인 크기로 회복되었으며 효소치료 이전에는 분명하게 나타났던 골격계의 손상들도 완전하게 교정되었다. 어린이와 성인 환자간의 차이가 나는 결과에 대한 해석은 임상적인 효과를 보기에는 충분하지 않은 효소만이 성인에게 주입되었다고 결론지었다.
(f) 용량반응과 임상유효성 시험
기존 시험의 혈액학적 반응들에서 일관성이 없었던 점들의 이유를 성인 환자들에게 불충분한 용량 때문이라고 해석하였고, MT-Glc-Cer’ase의 여러 다른 농도를 주입하였고 그 전후의 간생검을 실시하여 용량반응시험을 실행하였다. 간에서의 Glc-Cer의 가장 일관성 있는 감소는 체중대비 60 unit kg -1을 투약한 후에 발견되었다. 이를 근거로 1형 고셔 병 환자 중 비장절제를 하지 않은 12명의 환자를 대상으로 임상유효성 실험을 고안하였다. 환자의 나이는 9 ~42세였는데, 모두에게서 헤모글로빈과 혈소판 수치가 월등하게 향상되었고, 비장과 간의 크기가 감소하였으며 고셔 병의 골격계의 증상들이 호전되었다. 이 결과를 근거로 1991년 4월 5일에 미국 식약청은 MT-Glc-Cer’ase를 고셔 병 환자들의 치료제로 승인하였다. 젠자임 사 (Genzyme Corp.)는 그 후에 Glc-Cer’ase를 유전자 재조합 기술을 이용하여 차이니즈 햄스터 오바리 (Chinese hamster ovary) 세포에서 생산하였다. 이 제품은 태반유래 효소와 똑같은 유효성이 입증되어서 1994년도에 미국 식약청에서 고셔 병 치료제로 승인되었다. 이 치료법은 추가로 54개국의 규제기관에서 승인되었다. 2003년도 기준으로 고셔 병 환자 3천명이 효소대체치료법을 받고 있다. 100 개 이상의 문헌을 통해서 고셔 병 환자에서 효소 대체술이 유효함이 보고되었고 그 요약본도 정리되어 출판되었다(3).
결론
다른 질병에의 효소대체치료법 적용과 최신 접근방법
유사한 접근방법이 파브리 병, 뮤코다당체 침착증, 헌터 증후군, 폼페병 등의 저장성 질환에 성공적으로 적용되어 의약품으로 승인되었다. 효소를 발현시키는 전체 유전자가 삭제되지 않고 단위 아미노산수준의 돌연변이에 의해 생긴 약한 형태의 비활성 (mildly active) 이상접힘 단백질 (misfolding protein)을 가진 파브리병 환자에서 약리학적 샤페론을 투약하여 활성을 회복시키는 노력들이 현재 임상3상 단계에서 진행 중이다. 이런 최신 접근법은 기존의 단백질 의약품이 아니라 작은 분자량의 소화합물을 약물로 사용하기 때문에 파브리병에서 성공할 경우 신경병적인 2형/3형 고셔 병의 경우에도 적용되어 중추신경계로 전달시킬 수도 있다는 미래전략을 제공하고 있다(4,5).
참고문헌
1. Brady, RO, Phil. Trans. R. Soc., 2003, 358,915~919
2. http://history.nih.gov/exhibits/gaucher/index.html
3. Weinreb, NJ 등 Am. J. Med., 2002, 113, 112-119
4. Fan, JQ, Trends in Pharmacological Sciences, 2003, 24, 355-360
5. http://www.amicusrx.com/programs.aspx
이전
2013.02.04
다음
2013.04.01