통상적으로 신약개발 과정은 질병에 대한 작용점 선정, 약물 스크리닝, 약물 최적화 등의 신약 연구 단계와 전임상, 임상 1, 2, 3 상 시험 및 FDA 심사, 등록 등 개발 단계의 복잡한 과정을 거치게 되며, 일반적으로 10 ~ 15년의 오랜 기간과 평균 10억 달러 이상의 자금이 소요되는 과정으로 알려져 있다. 한편, 최근 들어 생물학, 약학, 독성학 및 의학 등 신약개발 관련 학문 분야의 급격한 발전으로, 약물에 대한 작용기전의 이해와 이를 통한 다양한 약물 작용 및 독성에 대한 이해도가 높아지고 있다. 그리고 이러한 기술의 발달이 신약개발의 효율성을 높여 줄 것으로 기대하였다. 그러나 이러한 기대와는 달리, 최근의 의학 관련 기술의 발달이 보다 높은 수준의 약물안정성과 예측가능성의 요구로 이어져서, 아직까지는 개발 비용 증가의 원인이 되고 있는 실정이다. 물론 앞으로 꾸준한 기술의 발달과 보다 많은 정보의 축적이 궁극적으로는 신약개발의 효율화를 이룰 수 있을 것으로 판단된다. 하지만, 이러한 과도기적 비효율성을 극복하고 기존 약물의 가치를 높이는 방법으로써 최근 drug repositioning(신약재창출) 기술이 관심을 받고 있다 (그림 1).1-3
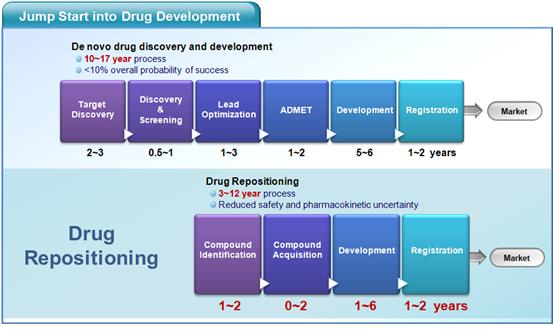
그림 1. 일반적 신약개발과 Drug Repositioning 기술 적용에 의한 신약개발 효율성 비교
Drug repositioning 기술은, 시장에서 이미 판매중이거나 임상단계에서 안전성 이외의 이유로 산업화에 실패한 약물들의 새로운 의학적 용도를 개발하는 신약개발의 한 방법이라 할 수 있다. 따라서, 이미 안전성이 검증된 약물을 활용함으로써 비용절감 및 개발 기간의 단축을 이룰 수 있다는 장점이 있다. Drug repositioning을 사전적으로 정의하자면, 약물의 구조를 바꾸지 않고 새로운 적응증을 찾는 과정이라 할 수 있으며, 단지 용법이나 용량 등을 바꾸는 정도의 변화 과정이라 할 수 있다. 그렇지만, 최근에는 약물의 제형 또는 일부 화학구조를 변경시킴으로써 약물의 전달 속도, 약효, 안전성의 향상 등을 꾀하는 경우도 drug repositioning의 범주에 포함시키는 추세이다. 한편, 기존 약물의 구조나 제제, 용도 등을 일부 변형시킴으로써 약물 전달속도, 약효, 안정성 등의 약물성의 향상을 통해 얻어지는 약물을 통칭 개량신약이라고 하는데, drug repositioning은 새로운 적응증의 창출이라는 관점에서 개량신약과 구별되어 독립적인 하나의 신약개발 전략으로 간주되고 있다.1,3
지금까지는 drug repositioning에 의한 신약개발은 의도된 신약개발 전략이라기보다는 우연한 발견(serendipity)에 의한 경우가 대부분이었다. 최근에는 대단히 계획적인 시스템의 활용으로, 임상의학 및 첨단 생물학적 정보에 기반한 새로운 개념의 drug repositioning 기술이 시도되고 있다. Celgene사는 1957년 임신부의 입덧 완화를 위해 출시되었다가 기형아 출산 등의 부작용으로 1961년에 시장에서 퇴출되었던 Thalidomide를, 이의 작용 기전을 기반으로 다발성 골수종 및 나병 치료제로 1998년 FDA 허가를 받아 현재까지 사용하고 있다. 또한, Forest Laboratories와 Cypress Bioscience사는 항우울제로 개발 중이던 Milnacipran을 섬유조직염 치료제로 전환 개발하였다. Pfizer는 협심증과 고혈압치료제로 개
발 중이던 Sildenafil과 Minoxidil을 각각 발기부전치료제와 대머리치료제로 적응증을 전환하여 개발함으로써 새로운 blue ocean형 치료제 시장을 개척하였다. 그리고, Lilly는 항우울증제, 항바이러스제, 유방암치료제로 개발한 Duloxetine, Gemcitabine, Raloxifene을 요실금치료제, 항암제, 골다공증치료제로 각각 새롭게 허가를 받았다. GSK의 경우는 항우울증제로 개발한 Bupropion을 금연보조제로 새롭게 개발하였다. 이러한 사례들 중, Raloxifene과 Duloxetine 등은 이미 시장에 출시된 약물을 이용한 사례이고, Sildenafil과 Minoxidil 등의 경우는 신약개발 임상시험 과정에서 새롭게 repositioning된 경우이다. 결국 지금까지의 대부분의 연구가 작용 기전에 기반을 두기보다는, 현상학적 임상 결과를 기반으로 새로운 적
응증을 찾는 경우가 대부분이었음을 알 수 있다 (표1).3,4
표 1. Drug Repositioning의 성공사례
| Company | Repositioning Drug | Repositioning Type |
Date | Value | Reference |
| Celgene | Thalidomide (Thalidomid) |
Erythema nodosum laprosum (ENL), Multiple myeloma |
1998 | $224 million in 2003 (US) |
Drug Repositioning strategies 2007 by Data monitering(p22) |
| Forest Laboratories/ Cypress Bioscience (Buyer/Seller) |
Milnacipran | Fibromyalgia | 2004 | US $25 million, Up to US$250 million in milestones | Touch Briefing 2006 Drug Repositioning - Drug Discovery 2006 |
| Pfizer | Sidenafil (Viagra, Revatio) |
Erectile dysfuntion, pulmonary arterial hypertension | 2007 | $2 billion | Drug Repositioning strategies 2007 by Business Insight(p19) |
| Pfizer | Minoxidil (Rogaine) |
Baldness | 1998 | $162 million in 1995 |
Drug Repositioning strategies 2007 by Data monitering(p77) |
| Lilly | Duloxetine (Yentreve) |
Stress urinary incontinence (SUI) | 2007 | $0.8 billion | Drug Repositioning strategies 2007 by Data monitering(p21) |
| Lilly | Gemcitabine (Gemzar) |
Cancer | 2007 | $1.2 billion | Drug Repositioning strategies 2007 by Business Insight(p19) |
| Lilly | Raloxifene (Evista) |
Osteoporosis | 2007 | $1 billion | Drug Repositioning strategies 2007 by Business Insight(p19) |
| GSK | Bupropion (Zyban) |
Help smoking cessation | 2002 | $125 million in 2003 |
Drug Repositioning strategies 2007 by Business Insight(p114) |
한편, Drug Repositioning은 새로운 약물의 적응증을 발굴해 냄으로써 기존약물의 유용성과 시장을 확대함은 물론, 특허 독점 기간의 증가를 통한 약물의 제품수명 확대라는 차원에서도 매우 유용한 전략이 될 수 있다. 안전성이 검증된 약물이라 하더라도 새로운 적응증 적용을 위해서는 별도의 임상시험이 필요하며, 따라서 미국에서는 신규 적응증에 대한 3년의 독점기간을 부여하며, 별도로 소아질환에 대해서는 6개월의 독점권을 추가로 더 연장해주며, orphan drug에 대해서는 7년의 독점기간을 부여하고 있다. 또한, 개발 중이던 약물이 새로운 적응증을 대상으로 신규로 승인되는 경우, 특허 존속기간이 얼마 남지 않은 약물을 대상으로 5년간 특허기간을 연장해주는 제도도 운영하고 있다. 이러한 이유로 drug repositioning은 제약사의 신약 개발 innovation gap을 메우기 위한 전략으로써도 매우 유용한 방법이 되고 있다 (표2).4
표2. Drug Repositioning 약물의 시장 독점권 연장 현황
| 약물 | 회사 | 최초 적응증 | 재창출 적응증 | 독점권 |
| 미허가 약물의 신규 적응증 | ||||
| Retrovir (AZT, zidovudine) |
ViiV Healthcare (GSK/Pfizer) | 암(1960년대에 임상 보류; 1974년에 항바이러스효과) | AIDS (100 mg 캡슐, 1987 승인) | 2005년 AIDS 용도특허 만료; 1991년 ANDA 특허도전(실패); 2005년 제너릭 |
| Viagra (sidenafil) | Pfizer | 폐 동맥고혈압(발기부전증으로 먼저 출시됨; Revatio) | 발기부전(25/50/100 mg tab, 1998 승인) | 2012년 물질특허 만료; 2019년 발기부잔 용도특허 만료; 2012년 제너릭 Revatio (20 mg) tab의 off-label 사용 |
| Thalomad (thalidomide) | Celgene | 멀미(최기성으로 판매중지) | 나병성 결절성 홍반(ENL); 다발성 골수종 | 2013년까지 orphan drug 독점권; 2020년까지 순차적으로 용도특허 만료됨. |
| Mozobil (plerixafo) | Genzyme | HIV 저해제(미출시) | 조혈모세포 가동화를 위해 다발성 골수종에 G-CSF와 병용사용 | 2013년 물질특허 만료; 조혈모세포 가동화 용도특허 2023년 만료; 2013년 NCE 독점권 만료; 2015년 orphan drug독점권 만료 |
| 출시 약물의 신규 제형 | ||||
| Aplezin (bupropion HBr) | Sanofi-Aventis | 우울증(API HCl염, no HBr염) | 우울증(1일 1회, 안정성과 BA 향상, 2008년 승인) | 물질 및 용도특허 2026년 만료 |
| vivitrol (naltrexon) | Alkermes | 마약중독 및 알코올 의존성(50 mg tab, 1994년 승인) | 마약 의존성 재발 및 알코올 의존성 방지(서방형으로 월 1회 주사; 복용 편이성 향상; 2006년 승인) | 2029년에 용법특허 만료. 재발 적응증의 독점권은 2013년 만료) |
| 출시 약물의 신규 적응증 | ||||
| Cymbalta (duloxetine) | Lilly | 스트레스성 배뇨장애(2004년 유럽승인, 미국 미승인), 우울증(2004년 승인) | 우울증의 지속치료(2007년 승인); 불안증 (2007년 승인); 섬유근육통(2008년 승인); 불안증 지속치료(2009년 승인); 만성 근골격통(2010년 승인) | 섬유 근육통 용법특허 2019년 만료; 2014년까지 타 적응증 특허 만료; 불안증 시장독점권 2012년 만료 |
| 출시 약물의 신규 제형 및 적응증 | ||||
| Propecia (finasteride) | Merck | 양성 전립선비대(Proscar 5 mg tab; 2005년부터 제너릭) | 남성형 대머리(Propecia 1 mg tab; 제너릭 없음) | 양성 전립선비대 용법특허 2006년 만료; 남성형 대머리 용법특허 2013년 만료 |
| Zyban (bupropion HCl) | GSK | 우울증(Wellbutrin, 1985; Wellbutrin 서방형 1996년 승인) | 금연(Wellbutrin 서방형 150 mg 1997년 승인) | 서방현 제제특허 2013년에 만료 |
| Silenor (doxepin) | Somaxon | 우울증 및 불안증(10, 25, 50, 75, 100 mg 캡슐, 1986년 승인) | 불면증(저용량 3, 6 mg tab, 2010년 승인) | 용도특허 2027년 만료(식사 후 적어도 3시간 후에 투여 라벨필수); 시장독점권 2013년 만료 |
| Bildil (hydralazine & isosorbide dinatrate) | Nitromed | 고혈압(25, 50 mg tab)/ 혈관확장제(20 mg tab) | 심부전증(37,5/20 mg tab; 2005년 승인) | 용도특허 2020년 마료; 저가 제너릭 off label의 복합 사용으로 경쟁상태 |
| Revatio (sildenafil) | Pfizer | 페동맥성 고혈압(Viagra가 발기부전으로 먼저 승인) (Viagra 25/50/100 mg tab) | 페동맥성 고혈압 (20 mg tab 2005년 승인; iv 제제 2009년 승인) | 특허 및 시장 독점권 2012년 만료; 2012년에 발기부전으로 제너릭 Revato의 off label 사용가능) |
참조 : 약물재창출 핵심기술동향분석, 한국화학연구원(2013)
한편, 전통적 의미의 drug repositioning과는 차이가 있지만, 주로 항암제 분야에서 맞춤형 치료제의 개발이 급속히 진행됨으로써, 새로운 암종에 대한 적응증 확대 전략 역시 drug repositioning 과 유사한 형태로 진행되는 경우가 늘고 있다. Clizotinib의 경우 c-Met을 표적으로 하는 항암제 개발 중에 ALK에도 적용이 가능한 것을 발견하여, drug target을 변경하여 우선 허가를 받은 경우로 암이라는 적응증 자체는 변환되지 않았으나 치료 환자군 측면에서 새로운 적응증을 찾은 경우이다. 앞으로도 이러한 맞춤형 치료 repositioning 전략이 지속될 것으로 판단된다.5-7
1) 약물 표적에 따른 분류
Drug Repositioning을 위한 약물들의 경우 대부분 처음 약물 개발 시의 작용점을 알고 있음으로 이의 활용에 따라 크게 on target 및 off target 전략으로 구분할 수 있으며, 최근에는 비교적 빠른 시간과 저렴한 가격으로 유전체 발현 분석이 가능해짐으로써 pharmacogenomics를 이용한 방법 등도 활용되고 있다.
① New target-Disease Relationship(On Target 전략): 최초 약물 개발을 위한 표적의 다른 적응증 적용 가능성을 분석하여 repositioning하는 방법이다. Drug target 과 새로운 질병과의 연관성 규명으로 약물의 새로운 적응증을 찾고, 이를 통해 약물의 새로운 용도를 개발하는 전략이다 (그림 2, right panel).
② New drug-New target Relationship(Off Target 전략) : 알려진 약물들을 다양한 스크리닝 시스템에 적용함으로써 새로운 약물 표적과의 연관성을 규명하고, 이를 통해 약물의 새로운 용도를 찾는 전략이다. 이 경우 약물의 처음 표적과는 다른 표적을 통한 치료제 개발이 이루어지게 된다 (그림 2, left panel).
③ Pharmacogenomics를 이용한 접근법: 최근 유전자 분석 기술의 발달과 더불어 개발되고 있는 방법으로, 약물처리에 따른 유전체 발현 변화를 분석함으로써 새로운 작용점 및 적응증을 찾는 방법이다. 이를 활용하면, 효능뿐만 아니라 안전성 문제로 실패한 약물에 대한 새로운 문제 해결방법의 제시도 가능하다.
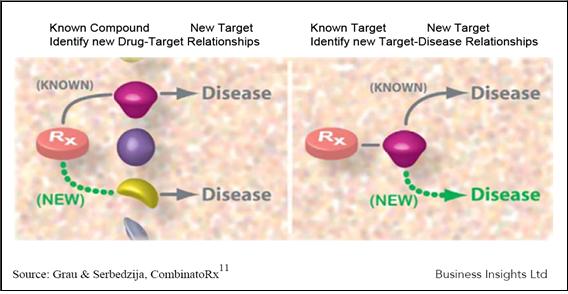
그림 2. Drug Repositioning을 위한 접근법
2) 약효검색 방법에 따른 분류
지금까지의 drug repositioning은 우연한 임상적 관찰로부터 이루어 진 경우가 대부분이었다. 최근 들어 drug repositioning이 신약개발을 위한 하나의 전략으로 자리를 잡으면서, 기존의 신약개발 과정과 동일한 방법들을 적용하여 보다 체계적인 연구를 이루려는 시도들이 집중되고 있다. 즉, 일반적인 신약개발 과정에서 활용되는 enzyme-based drug screening, cell-based drug screening 및 animal-based drug screening 방법들이 모두 drug repositioning 전략에 활용되고 있으며, in silico drug screening 방법 역시 이러한 drug repositioning 전략에 활용되고 있는 추세이다. 이들의 기반 기술 및 전략을 정리하면 아래 표 3과 같다.4,8-10
표 3. Drug Repositioning을 위한 약효검색법 활용 비교
| in Clinic | in Vivo | in Vitro | In Siloco | |
| Basic Methods | Clinical Investigation Pharmaceutical Markers |
Disease models in rodents and zebrafish and nematodes. Real time animal imaging Kinetic markers Metabolomics Imaging studies in humans |
Cell-based phenotypic assay in multiple or focussed disease areas Pathway analysis Surrogate assays |
Database mining in Silico biology |
| Targets | On/Off Target | On/Off Target | On/Off Target (Cell-based) Off Target (Enzyme-based) |
Off Target |
| Company | Ore pharmaceuticals Melior KineMed DanioLabs |
Ore pharmaceuticals Celentyx CombinatoRx Dynogen |
Ore pharmaceuticals CombinatoRx KineMed |
참고 : PharmaVision.co.uk (Business Insights Ltd), Drug Repositioning Strategies, Data
Monitering(2007)
앞에서 언급한 여러 가지 장점에도 불구하고, Drug Repositioning을 통한 신약개발 전략은 활용할 수 있는 약물의 제한에 따른 문제점들이 발생할 수밖에 없는 한계 역시 지니고 있다 (표 4). Drug repositioning 전략의 가장 근원적인 문제로는 약물의 제한에 따른 지적재산권 문제를 들 수 있다. 이 외에도 약물의 임상 데이터에 대한 접근 제한성 등의 한계로 인해 필연적으로 이를 극복하기 위한 체계적이고 독창적인 개발 전략을 필요로 한다.4
표 4. 통상적인 신약개발전략과 Drug Repositioning 전략의 장단점 비교
| 장 점 | 단 점 | |
| Drug Repositioning |
개발기간 감소 위험 및 비용 감소 엄청난 잠재적 파이프라인 새로운 사업모델에 대한 기회 |
de novo 신약개발 약물 의존에 따른 활용 가능 약물의 제한성 어려운 약물 접근성 지적재산권 고려 각종 규제 고려 파트너와 개발이익 공유 |
| De Novo Drug Development |
잘 확립된 과정 확립된 세계적 규제 인프라 무한정한 파이프라인 약물 강력한 지적재산권 보호 장치 독자적 상업화이익 확보 |
고갈중인 신약 파이프라인 비용증가에 따르지 못하는 생산성 고비용/장기 개발기간 개발후기 실패에 따른 위험성잠재 |
참고: Drug Repositioning strategies, Data monitering, 2007
신약개발을 통한 제약 산업 비즈니스 전략의 핵심은 의약품 등록과 지적재산권을 통한 시장 독점권(regulatory exclusivity) 확보로 정의할 수 있다. 이에 따라, 제약 산업 분야에서는 약리성분(Active pharmaceutical ingredient, API)을 포함하는 물질 특허가 가장 강력한 무기로 작용하며, 새로운 제형과 전달체 관련 특허로 이를 뒷받침하는 전략이 주로 사용된다.
한편, repositioning된 의약품들은 이미 개발기간이 상당 부분 경과하여 허가시점에 API 관련 특허가 이미 만료되었거나, 만료시점이 얼마 남지 않은 경우가 대부분을 차지하는 것이 현실이다. 현재 drug repositioning 용 약물로 상업적 구매가 가능한 2,800 여 종의 FDA 허가 약리성분 중 80% 이상이 특허 만료 상태인 것만 보아도, drug repositioning에서 특허확보 전략이 차지하는 비중이 얼마나 큰 지를 짐작할 수 있다. 따라서, 새로운 적응증 및 투여방법 등을 통한 용법특허 획득 등의 노력이 필요하며, 미국의 Hatch-Waxman Act 등의 규정을 활용한 특허 만료 이후의 독점권 기간 연장 등의 제도를 적극 활용할 필요성이 있다.4,13,14
현재 미국과 일본을 비롯한 선진국에서 drug repositioning 기술은 신약개발의 비용적 효율성이란 측면에서 각광을 받고 있으며, 이에 대한 투자도 증가하는 추세에 있다.
Pharma2012에 의하면 2010년 제약회사의 전체 연구개발비는 674억 달러로 추정되며, 이중 약 40%인 200-250억 달러 정도가 repositioning에 투자된 금액으로 추정된다. 그러나 이러한 수치적 효율성만을 가지고 우리나라가 선진국 모델을 그대로 따라하는 데는 몇 가지 문제점을 내포하고 있다. 첫째로, 앞에서도 언급한 바와 같이 약물의 지적재산권 확보의 문제를 들 수 있다. 외국 거대 제약사의 경우 drug repositioning이 가능한 자체 약물들을 각 회사 별로 수 백 종 이상씩을 확보하고 있으며, 이 물질들의 지적재산권 역시 당연히 해당 회사가 소유하고 있다. 그러므로 이들 제약사에게는 약물의 새로운 적응증 확보가 바로 신약개발과 같은 효과를 지닐 수 있다. 한편, 우리나라 제약회사의 경우 drug repositioning이 가능한 수준의 자체 보유 약물이 절대적으로 부족한 실정이다. 최대 수십 종 정도의 약물을 가지고 하는 drug repositioning의 경우, 당연히 효율성 측면에서 선진 대형 제약사와 같은 수준을 기대하기 어려운 현실이다. 이러한 이유로 선진 대형 제약사의 경우 drug repositioning 연구가 가능성 및 안전성 측면에서 보다 효율성이 높을 것으로 기대되는 on target drug repositioning 전략을 주로 활용한다. 반면, 우리나라의 경우 당분간은 off
target 전략 위주의 연구를 수행할 수밖에 없는 현실이다. 한편 최근에 외국 대형 제약사들이 임상 시험 이외에 대부분의 신약 연구 및 개발 부분을 outsourcing하는 추세에 있음으로, 이런 대형 제약사의 약물을 활용한 drug repositioning 협력 및 기술이전 전략도 가능해지고 있으며, 이러한 환경을 적극 활용하는 전략 역시 매우 유용할 것으로 판단된다. 두번째로 off target drug repositioning의 경우 성공 가능성을 높이기 위해서는 다른 연구자들이 수행하지 않은 새로운 약물 표적을 대상으로 하는 연구가 필수적이다. 그러나 우리나라의 경우 이러한 검증된 자체 약물 표적의 확보 역시 미흡한 수준이다. 따라서 이를 해결하기 위한 전략 역시 선진 대형 제약사와는 다른 모델을 만들어야 하며, 이의 효율화를 위해 drug repositioning이 가능한 약물들을 public sector를 활용하여 구축하고, 이를 국내 신약연구자들이 공동으로 활용하는 전략이 필요하다. 이러한 시스템을 통해 국내 제약사가 자체 보유하고 있는 drug repositioning용 약물도 공동 활용할 수 있는 시스템을 만든다면, 국가적 차원에서 외국계 대형 제약사와 경쟁할 수 있는 수준의 연구가 가능할 것으로 기대된다. 따라서 이러한 약물들을 구축하고 이를 database화 할 수 있는 기반 조직의 운영과 국내 연구자들이 이를 활용할 수 있는 방안의 마련이 필요하다 하겠다.
참고문헌
1. Padhy, B.M., Gupta, Y.K. Drug repositioning: re-investigating existing drugs for new therapeutic indications. J Postgrad Med. 2011, 57(2),153-60.
2. Liu, X., Zhu, F., Ma, X.H., Shi, Z., Yang, S.Y., Wei, Y.Q., Chen, Y.Z. Predicting targeted polypharmacology for drug repositioning and multi- target drug discovery. Curr Med Chem. 2013, 20(13),1646-61.
3. O'Connor, K.A., Roth, B.L. Finding new tricks for old drugs: an efficient route for public-sector drug discovery. Nat Rev Drug Discov. 2005, 4, 1005-14.
4. 최상운, 김광록, 박지훈, 오광석, 이병호, 이선경, 채종학, 김대경, 최종민, 약물재창출 핵심기술동향분석 (Core Technologies for drug Repositioning: Current status, trends and perspectives), 한국화학연구원 2013.
5. Roberts, P.J. Clinical use of crizotinib for the treatment of non-small cell lung cancer. Biologics. 2013, 7, 91-101.
6. O'Bryant, C.L., Wenger, S.D., Kim, M., Thompson L.A. Crizotinib: a new treatment option for ALK-positive non-small cell lung cancer. Ann. Pharmacother. 2013,47(2), 189-97.
7. Brana, I., Siu, L.L. Clinical development of phosphatidylinositol 3-kinase inhibitors for cancer treatment. BMC Med. 2012, 11(10), 161.
8. http://www.caliperls.com/products/contract-research/in-vivo/
9. http://www.orepharma.com/
10. http://www.kinemed.com/
11. http://www.biovista.com/
12. http://www.meliordiscovery.com/
13. Trascriptional data: a new gateway to drug repositioning? Drug Discovery Today 2012, 1-8.
14. Henry, N. Taking science to market: From start-up to big business. WellcomeScience Feb. 2008, 35-37.