임상시험의Quality management
- Risk based approach를 중심으로 -
코반스코리아서비스(유)
대표 안종호
<들어가면서>
임상시험은 신약개발에서 가장 많은 자원이 투입되는 단계이며, 이 과정에서 필요로 하는 바를 충실히 계획하고 수행하며 정리하는 것의 중요성은 모두가 인지하는 바 이다. ‘Quality’라는 영문단어는 다양하게 번역되고 정의될 수 있으나, ‘목적하는 바에 부합하는 정도’(‘Fitness for purpose’)의 정의를 인용한다면, 임상시험의 Quality는 ‘임상시험이 그 목적을 충실히 달성하는 정도’라고도 말할 수 있다. 즉, Sponsor의 입장에서는 임상시험에 많은 비용을 들여서 진행하는 만큼, Quality를 확보하는 것이 목적 달성에 매우 중요하다고 표현할 수 있겠다.
그동안 Sponsor는 임상시험의 Quality guideline인 임상시험관리기준(Good Clinical Practice, GCP)에 맞추어 임상시험을 윤리적이고 과학적인 국제기준에 맞게 진행되도록 노력하여 왔으나, non-compliance에 대한 주요규제기관의 지적은 계속되고 있다. 또한 이와 같은 상황에서 Sponsor는 한편으로는 임상시험의 난이도, 지역적 분포, 규모증가 등 이전과 다른 challenge를 관리하여야 하며, 다른 한편으로는 임상시험의 비용을 절감하라는 시대적 요구를 함께 수용해야 하는 어려움에 직면한고 있다. 즉, Sponsor가 답을 요청받고 있는 질문들의 예는 다음과 같다. 임상시험의 모니터요원이 100% 근거문서검토(Source Document Verification, SDV)를 하는 중에서도 Quality finding을 누락하는 경우가 있는 상황에서, 비용절감을 위하여 SDV의 비율을 줄이고 모니터링 방문의 회수를 줄이는 Sponsor의 결정은 해당 임상시험에서 어떠한 결과를 초래할 위험이 있는것인가? 임상시험의 Quality제고를 위하여 비용이 발생하는 활동을 늘려야 한다면, Sponsor의 결정권자는 어떠한 반응을 보일 것인가?
이상과 같이 진퇴양난의 어려운 상황에 이른 것은, 임상시험의 Quality management가 전통적인 system만으로는 더이상 충분하지 않으며, 다른 변화를 모색하여야 한다는 것을 의미한다. 이러한 추세에 발맞추어, 2013년에 발간된 US guidance document 및 EMA reflection paper는 임상시험의Risk-base approach를 소개하여Quality management에 대한 새로운 시각을 제공하고 있기에 소개하고자 한다.
<FDA와 EMA의 Guidance document소개>
그동안 FDA[1]와EMA[2]는 임상시험의 Quality management가 Protocol의 Risk에 기반하여야 함을 지적한 바 있다. 즉, 그동안 피험자의 안전, 자료의 합치성 등의 Quality risk에 대하여 우려를 표명하여 왔으며, 이는 임상시험에서 발생할 수 있는Risk항목들이 모두 서로 다른 중요도를 가지고 있음에도 불구하고 동일한 듯 취급하여 온 기존 관행의 불합리성에 기인한다고 하였다. 따라서 양 기관은 임상시험의 Risk에 대하여 보다 합리적으로 접근하는 새로운 노력이 필요하다고 역설하였으며, 그 system의 큰 틀은 EMA paper에서 다음과 예시를 통하여 개괄적으로 설명하고 있다.
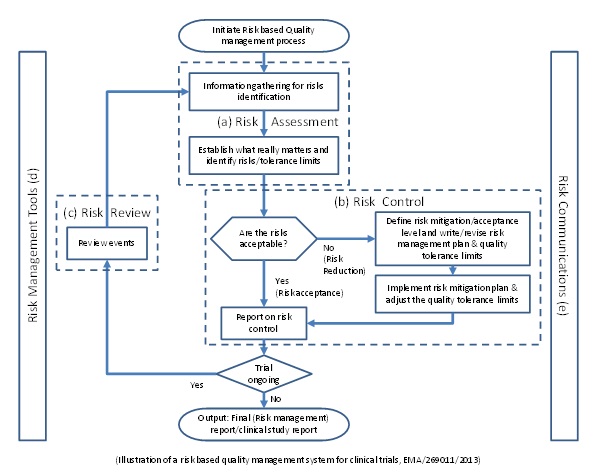
(a) Risk assessment: GCP의 관점에서 임상시험에서의 Risk를 발견 및 평가하고 중요도의 우선순위를 정한다.
(b) Risk control: Risk의 수용수준과 각 Risk에 대하여 사용할 수 있는 방법들을 정의하고, Risk관리계획을 정한다.
(c) Risk review: 임상시험의 수행 중 발생하는 시험의 내외부에서 새로운 정보를 통하여 Risk를 지속적으로 재평가하고, Risk management plan에 미치는 영향을 가늠한다.
(d) Risk management tool: 평가지표를 측정하고, 추적하며 분석 및 예측하여, Risk management system과 의사결정을 지원한다.
(e) Risk communication: Risk와 관련된 내용을 각 관련당사자에게 전달한다.
개론적으로는 지금까지 Project management에서 수행하고 있는 Risk management plan과 같다고 속단할 수 있다. 그러나 최근에 개발되어 사용되는 임상시험의 관리도구들이 제공하는 추가된 기능을 고려하여 다시 살펴보면, 지금까지의 Static risk management에서 Dynamic risk management로 변화하면서 발생하는 차이를 확인할 수 있다. 즉, 1) IT platform과 통계적 기술의 발전에 힘입어 각 기능에서 실시간으로 임상시험을 관리하는 Central monitoring, 2) Central로 진행되는 Remote monitoring과 On-site monitoring의 적절한 조화, 3) 개인형 맞춤치료와 같이 각 Protocol의 개발단계, 난이도, 대상질환, 지역적 분포 등에 따른 맞춤형 Risk assessment, 4) 임상시험에 참여하는 연구기관에 대한 Risk profiling 및 monitoring, 5) 임상시험의 상황을 Real-time으로 감지하고, 확인된 Risk dynamic에 따라서 Monitoring approach가 함께 변화하는 Risk-adapted trial monitoring process, 6) On-site monitoring이 고정된 Monitoring plan에 따라서 기계적인 반복작업을 하는 활동으로부터 해당 시점에서 피험자의 안전 및 자료의 정합성에 가장 중요한 부분에 집중하는 업무로 변화하는 등, 임상시험의 Quality management가 새로운 paradigm으로 진행할 수 있는 제반 여건에 대하여 설명하고 있는 것이다. 이와 같은 상황을 적용하여 위에 설명된 system의 구성에 추가되는 내용을 표현하면 다음과 같다.
(a) Risk assessment: IT platform의 발달에 따라서, 임상시험과 관련된 더 많은 자료를 Big data등의 형태로 Risk의 중요도 평가에 반영할 수 있다.
(b) Risk Control: 사전에 작성된 Monitoring plan등의 계획서에 따라 정해진 내용을 충실히 수행하는 작업에서, Risk평가에 따른 중요도 변화에 맞추어 Risk control에 투여하는 자원을 조정하는 작업이 된다. 즉, Risk가 높아졌다고 판단되는 상황에서는On-site monitoring의 빈도와SDV의 정도를 높이는 등의 더 많은 자원을 투입하는 결정을 내릴 수도 있고, 반대로 Risk가 낮아졌다고 판단하는 경우에는 자원투입을 하지 않는 결정을 내릴 수 있게된다.
(c) Risk review: IT platform의 발달은 Risk를 real time으로 재평하는 Central monitoring을 가능하게 해주고, 이를 통하여 의미있는 정보를 추론해내는 능력이 중요해진다. 또한, 새로 발견되는 Risk에 대하여도 평가할 수 있도록 하는 기능이 가능해진다.
(d) Risk management tool: Risk assess-control-review cycle을 뒷받침해주는 System은 Paper-base 또는 Electronic-base에 차별하지는 않겠으나, 궁극적으로는 이 능력이 임상시험관리의 전체적인 경쟁력을 좌우할 것으로 보인다.
(e) Risk communication: Dynamic 하게 변화하는 plan을 적용하여 관련당사자들이 일사불란하게 움직이기 위하여는 필수적인 내용이다.
이와 같은 개념은 임상시험의 Quality management를 문제를 발견하고 이를 Fix해 나가는 ‘Repair’의 개념에서, 전향적으로 Risk를 예측하고 적극적으로 관리하는 ‘Prevention’으로 변화시킬 것으로 보인다. 또한, FDA/EMA는 방법론에 대하여는 자세히 서술하거나 필요조건으로 말하고 있지 않지만, 적어도 향후FDA 및 EMA에 제출되는 자료는 Quality risk의 적절한 관리가 최종 신약승인 여부에 영향을 줄 것을 시사하고 있어서 모든 Sponsor의 관심을 필요로 한다.
<마치면서>
신약을 개발함에 있어서 그 비용을 절감하려는 노력은 어느 때보다도 높아지고 있다. 이와 함께, 임상시험에서의 Quality요구수준도 높아지고 있다. Quality failure는 최악의 경우 임상시험의 자료불인정으로 이어져 더 큰 비용을 발생시킬 수 있는 중차대한 문제임을 고려할 때, Sponsor는 비용절감과 충분한 Quality 확보라는 두 가지 목표를 달성할 방법에 관심을 가져야 한다.
Risk-based monitoring은 Less vigilance가 아닌 보다 향상된 Quality control에 그 목표를 두고 있으나, Risk를 적극적으로 낮추어 불필요한 자원투여를 제거함으로써 향상된 Quality와 비용절감을 함께 달성할 가능성도 제시하고 있다. 따라서, Risk-based approach는 Quality management system의 경쟁력에 따른 임상시험 관리의 경쟁력으로 연결될 것이며, 궁극적으로 피험자, 연구자, 의뢰자, 규제기관 모두의 만족도를 높이는데 기여할 것으로 예상된다.
<참고자료>
1. Guidance for Industry: Oversight of Clinical investigations – A risk-based approach to monitoring, US Department of Health and Human Services, Food and Drug Administration, 2013
2. Reflection paper on risk based quality management in clinical trials, European Medicines Agency, 2013
