표적항암제 개발에 따른 새로운 항암 임상 전략의 필요성
김영화. 아스트라제네카
1. 들어가며
최근 항암제 연구 개발의 큰 두 줄기 동향으로는 표적항암제와 면역항암제를 꼽을 수 있을 것이다. 그 중 특히 표적 항암제의 경우 약의 표적이 될만한 특정 암을 유발시키는 분자적변이 (molecular aberrations) 들이 차세대 염기서열분석 등 기술의 발달과 함께 다수 알려졌고, EGFR저해제와 같은 성공 사례 들에 힘입어, 현재 진행되고 있는 항암연구의 상당수가 이와 같은 변이를 약의 표적으로 하고 있는데, 이와 관련 연구 개발 초기부터 그 약에 반응을 할 것으로 생각되는 특정 변이가 있는 환자군을 찾아내는 연구가 동시에 매우 활발하게 이루어지고 있다.
반면 최근 각광을 받고 있는 면역항암제 표적의 경우는, PD-1/PD-L1 과 같이 환자의 항암 면역반응을 감소시키는 신호를 막아줌으로서 항암반응을 정상화 시키는 방법으로, 표적항암제와는 달리 보다 광범위한 환자군이 이러한 약에 반응을 할 것으로 생각되어, 다양한 암종과 비선택적 환자군을 대상으로 연구를 활발히 진행하고 있지만, 이 역시 반응/비반응 환자군을 대상으로 하는 후향적 하위그룹분석 (sub-population analysis)도 병행하는 추세이다.
앞으로의 항암제 연구개발의 동향으로는, 이러한 면역항암제와 표적항암제 각각에 대한 연구뿐만 아니라 이 두 가지 약물의 병용에 대한 연구가 매우 활발 해 질 것으로 예상되고 있다.
2. 표적항암제 임상의 어려움
초반 표적항암제의 경우 항암제에 반응하는 환자군과 그 환자군이 가지고 있는 분자적변이의 발견이 전체 환자를 대상으로 한 임상결과를 후향적으로 분석하는 과정에서 이루어 졌다. 예를 들어 비소세포암환자를 대상으로 하는 EGFR저해제의 임상결과에서, EGFR 활성돌연변이의 유무가 EGFR 저해제에 반응하는 환자군과 반응하지 않는 환자군을 구별하는 생물학적 지표이며 이런 활성변이를 가지고 있는 환자가 전체 비소세포암의 20% 정도를 차지 함을 임상결과 분석 및 추후 연구를 통해 알게 되었다. 이는 조직병리가 동일한 암종이라 하더라도 가지고 있는 암 유발 변이가 매우 다양하기 때문에, 추후 표적항암제의 연구개발에서는 각 변이에 따라 환자군을 미리 선택하여 임상을 하는 것을 개발 위험은 줄이고 충족되지 않은 니즈가 명확한 일부 환자군에게 약을 공급할 수 있는 윈윈전략으로 생각하고 있다.
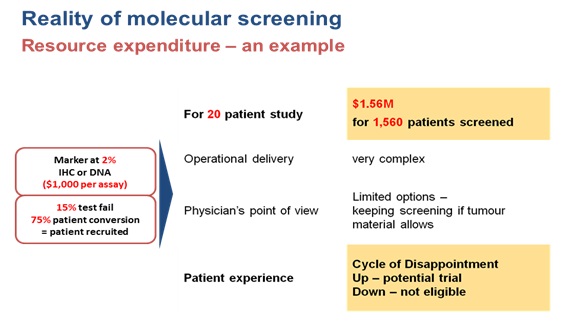
반면 아래 계산은 이러한 환자군이 전체 환자의 2% 로 매우 낮고, 환자 일인당 스크리닝에 드는 비용이 1,000 USD이며, 약 15%의 테스트 실패율을 가지고 있고, 등록 가능한 환자의 75%만이 임상에 등록된다고 가정 했을 때, 20명의 대상 환자를 임상에 등록하기 위해서는 총1,560명의 환자를 스크리닝 해야 하며, 스크리닝 비용만으로도 1.56M USD가 든다는 것을 보여준다. 이런 금전적인 문제만이 아니라, 시간적, 프로세스적인 문제와도 맞물려, 발생률이 현저히 낮은 분자적변이를 표적으로하는 표적치료제의 임상은 실질적으로 거의 불가능 하다고 보인다.
여기에 더불어 암종이 다른 경우 동일 변이를 가지고 있다고 하더라도 같은 표적항암제에 대한 반응이 다른 경우가 있는데, 예를 들면 B-raf 저해제인 Vemurafenib의 경우 BRAF V600E 변이를 갖고 있는 흑색종 환자는 잘 반응하는데 비해, 동일 변이를 갖고 있는 대장암 환자는 반응하지 않았는데 (kopetz S, Desai J, Chan E, et al: PLX4032 in metastatic colorectal cancer patients with mutant BRAF tumors. J Clin Oncol 28:269s, 2010 (suppl; abstr 3534)), 최근의 전임상 연구 결과에 따르면 대장암 환자에서는 EGFR이 활성화 됨으로서, B-raf저해와 상관 없이 세포가 분열함을 밝혀내었고 (Prahallad A, Sun C, Huang S, et al: Unresponsiveness of colon cancer to BRAF (V600E) inhibition through feedback activation of EGFR. Nature 483: 100-103, 2012), 이러한 발견에 따라 현재 EGFR 저해제와 BRAF저해제의 병용투여가 대장암에서 연구되고 있다.
또한 종양생검 에서 발견된 대다수의 변이들이 암의 다른 부위에는 존재 하지 않는 것으로 보고가 되고 있는데 (Gerlinger M, Rowan AJ, Horswell S, et al: Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med 366: 88) 이러한 intra-tumor heterogeneity 는 다중생검의 필요성을 대변해 주는 것이라 할 수 있겠다.
때문에 표적항암제의 연구개발에는 암유발변이를 찾고 그에 대한 화합물을 만드는 것뿐만 아니라, 그 변이를 표적으로 하는 것이 질병의 개량에 영향을 미친다는 것을 메커니즘적으로 각 암종에 따라 증명해야 하며, 실제 그 변이를 가지고 있는 대상환자가 몇 %이며, 그것을 정확성을 가지고 빨리 찾아낼 수 있는 방법이 있는가 등이 같이 연구 되어야만 비로소 그 화합물의 개발 여부와 방향, 그리고 그에 맞는 임상계획을 짤 수 있을 것이다.
3. 새로운 임상 방법의 시도
위에서 열거한 표적항암제 개발의 문제점을 극복하고자 환자유래tumor xenograft 등의 중개연구 방법들이 많이 사용되고 있다. 그러나 여전히 임상적 평가와 적합성평가를 거쳐야 한다는 문제점은 남아있다. 특히, 지금까지 알려진 신약으로 개발가능한 표적의 분자적변이 빈도가 그리 높지 않아, 한가지의 약을 전체 환자군을 대상으로 하는 임상이 아닌, 여러 가지의 약을 선택 환자군에 매칭하는 새로운 임상 방법들이 시도 되고 있다.
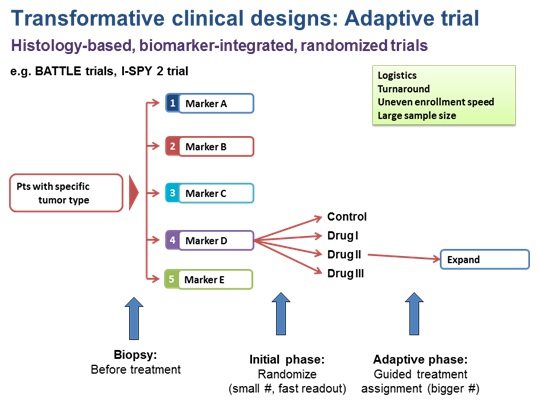
A. Adaptive clinical design
BATTLE-1, BATTLE-2, I-SPY2 등으로 대표 되는 임상의 한 방법으로, 조직병리학적으로 같은 암종만을 대상으로 하며, 바이오마커 확인을 임상 디자인에 포함시키는 방법이다. BATTLE 임상의 경우를 예로들면, 두 단계로 임상이 나누어져 있는데, 일단 첫 번째 단계 (initial phase)에서는 생검을 실시해 분자적변이를 확인하고, 환자를 각각의 약물과 대조군에 무작위배정을 한다. 이 첫번째 단계에서 얻어진 분자적변이와 임상적 유효성을 서로 비교해서 나온 결과를 토대로, 두 번째 단계 (adaptive phase)에서는 바이오마커와 약물을 매칭 시켜 더 많은 환자 그룹에서 그 효과를 확인 하는 방법이다. 이는 여러 개의 약물과 여러 바이오마커를 같이 연구하고 확인 할 수 있다는 장점은 있으나, 여전히 무작위배정를 위한 많은 수의 환자가 필요하다거나, 이로 인해 밝혀진 표적과 바이오마커의 연관관계가 연구된 한가지 암종에만 국한 되는 것 일수 있다는 문제점을 가지고 있다. 또한 각각의 바이오마커의 발생 빈도가 다를 경우 각 임상시험군마다 환자 모집의 속도가 다르기 때문에 가장 느린 임상시험군에서의 결과를 얻을 때까지 기다려야 한다는 문제점은 여전히 존재한다.
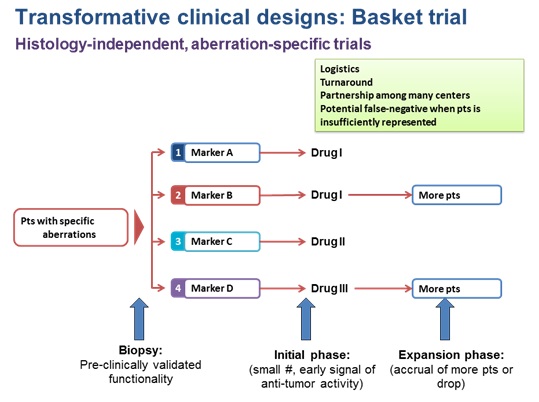
 B. Basket clinical design
B. Basket clinical design
이 경우에는 암종과 상관없이 동일한 변이를 가지고 있는 환자군을 가장 잘 반응을 보일 것으로 생각되는 약물과 맞춘 후 일단 적은 수의 환자에서 기준치료에 대한 이전 반응률과 비교, 일정 정도의 우월함을 보이지 않을 경우 중단 하거나, 반대로 우위를 보인 그 임상시험군 을 확장하는 방식을 쓸 수 있다. 이를 위해서는 전임상에서 변이와 약물간의 상관 관계가 매우 잘 연구가 되어 있어야 하고, 같은 유전자의 변이라 할 지라도 기능이 알려지지 않은 변이는 포함을 시키지 않는 등 임상 디자인에서 고려 되어야 할 부분이 많이 있다. 이러한 임상 디자인의 경우 각각 임상시험군 에서의 환자 모집 속도가 매우 다를 경우에도 다른 임상시험군 에서 얻은 결과에 영향을 미치지 않고, 새로운 임상시험군을 추가하거나, 반응이 없는 임상시험군을 뺄 수 있다는 장점은 있으나, 암종과 무관하게 환자가 배정되기 때문에 위 BRAF의 예처럼 암종에 따른 반응편차가 있고 동시에 그 암종이 타 암종에 비해 발생빈도가 낮을 경우 임상시험 결과에 매우 큰 영향을 미치게 된다는 단점이 있다.
 4. 마치며
4. 마치며
대부분의 약물의 경우 무작위배정대조임상연구는 약품 허가를 받기 위해 반드시 거쳐야 할 단계로 남아 있을 것이다. 그러나 표적항암제의 경우 이러한 방법을 사용하기 힘든 이유가 무엇이며, 이를 풀어나가기 위해 지금까지 어떤 새로운 방법과 전략이 사용되고 있다는 것을 간단하게나마 설명해 보았다. 무엇보다도 이러한 표적항암제의 연구와 개발 전략은 전임상연구 단계에서부터 철저한 계획을 세워 진행해야 만 한다는 것을 강조하며 이 글을 마칠까 한다.


