항생제 개발의 문제점과 개선방향 :
박테리아와의 전쟁에서 우리가 살아남을 수 있는가?
레고켐 바이오사이언스 조영락
인류의 삶과 질을 향상시키는데 있어 최고의 공로자로 인정받는 항생제는 현대사회에서 가장 중요한 약물의 하나이며, 최초의 항생제인 페니실린의 출시와 더불어 공유해온 박테리아의 내성을 극복하고자 수많은 항생제가 출시되어 왔다. 그러나 수많은 항생제가 있음에도 불구하고 내성의 계속 적인 증가는 이를 극복하고자 새로운 계열 및 개선된 항생제 개발의 필요성을 느끼게 만들었으나, 아래에서 논할 여러 가지 문제로 인하여 시장에 출시되는 항생제의 수는 2000년대 이후 급격하게 줄어들었다. 최근에는 이에 대한 전세계적인 대책수립의 필요성이 각계각층에서 제기되고 있으며, 기존 어떤 항생제에도 듣지 않는 슈퍼박테리아의 등장으로 항생제 개발 이전으로 돌아가는 것 아니냐는 우려 때문인지 최근 170억원의 상금을 걸고 부활한 경도상(Longitude Prize)의 주제가 “항생제 내성 극복방안” 으로 결정 되기도 하였다.
<1983년부터 2012년까지 출시된 항생제의 개수>
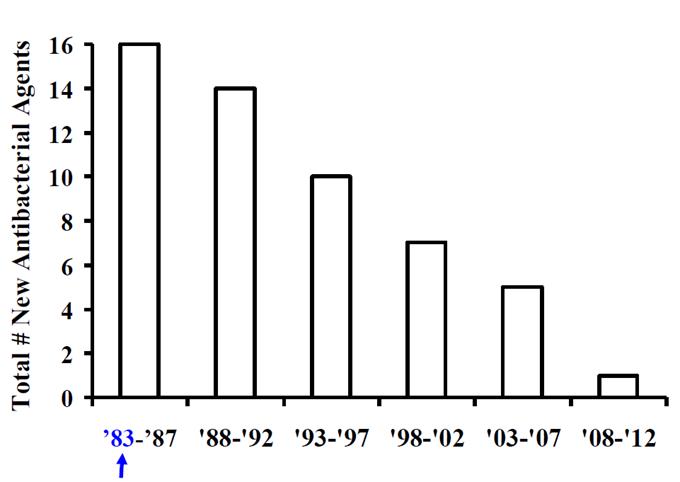
현대사회는 수요가 있으면 항상 공급이 이루어져서 적절한 이윤을 창출하게 되는 구조로 발전하고 있으나 최근 항생제 분야는 수요는 있으나 공급이 현저하게 줄어드는 양상을 보이고 있다. 이러한 현상이 나타나게 된 원인과 이에 대한 해결방안에 대해 간단하게 소개하고자 한다.
1. 항생제 공급 부족의 원인
항생제의 공급이 줄어든 가장 큰 이유는 다음의 3가지에 있다. 첫째 박테리아 내성을 극복하기 위한 항생제의 discovery (New Target)가 어려워 졌으며, 둘째로 discovery 를 통해 후보약물을 찾아 낸다 해도 임상에서부터 출시 단계까지 많은 어려움이 존재한다. 마지막으로 항생제 출시 후 경제적 측면에서 이익이 보장되어야 하는데 최근까지의 항생제 개발 비용 및 수익 관련 통계를 보면 대부분 적자를 모면하기 힘든 것으로 보고되고 있다.
가. 항생제 discovery 의 어려움
새로운 합성신약을 만드는 대부분의 초기단계는 타겟에 대한 약효를 가지는 Hit(유효물질)을 찾는 것이다. Hit 을 찾는 데는 보통 2가지 방법을 많이 사용하는데, 첫째는 수십 수백만 종의 화합물 library를 이용하여 HTS(High Throughput Screening)를 통해 얻는 방법이며, 둘째는 구조기반 약물디자인 (SBDD, structure based drug design) 방법이다. Big Pharma들이 2000 대 초까지 HTS 를 통한 항생제 hit 을 찾고자 하였으나 대부분 성공적이지 못하였으며 이로 인해 많은 제약사들이 서서히 항생제 discovery 를 포기하게 만드는 결과를 초래하였다. 또한 구조를 이용하여 Hit 을 찾는 방법은 아직 항생제에 적용하기에는 여러 제약이 많으며, 특히 항생제의 경우 내성이 잘 생기지 않을 타겟, 즉 약효 기전 두개를 동시에 타겟팅하는, 에 대해서만 유효하므로 적용할 수 있는 가능성은 제한적이다.
더욱이 Hit 을 찾더라도 후보물질(candidate) 이 되기 위해서는 박테리아 내부로 들어갈 수 있어야 하며, 들어가서 박테리아의 내성 기전 중 하나인 efflux pump에 의해 밖으로 다시 배출이 되지 않고, 더불어 원하는 조직 혹은 부위에서 고농도로 유지되어야만 약효를 나타낼 수 있다는 항생제의 특징을 갖춘 화합물을 찾아야만 비로소 개발에 들어갈 수 있게 된다. 이 경우 안정성 확보가 다른 약물 대비 훨씬 어려움을 겪게 된다.
이러한 경향은 다른 질환분야와 항생제 분야의 각 단계별 성공률의 차이를 보면 항생제 discovery 및 개발의 어려움을 극명하게 보여준다. 아래 표에서 나타나는 것처럼 항생제 분야는 초기 Lead까지 성공률이 현저히 낮으며 전체적으로 성공률이 100배나 낮게 나타나고 있다.
<항생제와 다른 질환 분야의 각 단계별 성공률>
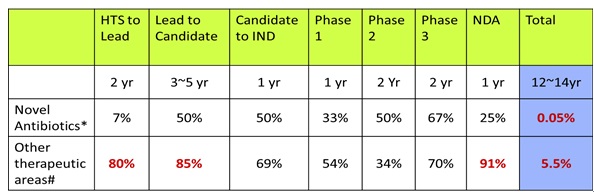
나. 항생제 개발의 어려움
일단 어렵사리 discovery 에서 후보물질을 도출하였다 하더라도 임상개발에 또 다른 복병들이 존재한다. 약으로 출시하기 위한 대부분의 개발비용은 후기임상에서 발생하며 이 비용을 낮추는 것이 개발사로서는 큰 과제중의 하나이다. 비용이 적게 들어가는 효과적인 임상 디자인은 우월성 (superiority) 를 보여 주는 것이며, 그렇지 못한 경우엔 비열등성 (non-inferiority)을 보여주는 임상 디자인을 하게 된다. 그러나 항생제의 경우는 우월성을 보여주는 임상을 하기엔 거의 불가능한 상황이다. 이유로는 첫째, 위약 (placebo) 를 사용하는 것이 불가능 하며 둘째, 효과가 없는 대조약물을 환자에게 사용 할 수 없기 때문이다. 효과가 없는 약물이나 위약의 사용은 환자의 생명을 위협하는 일이므로 이러한 우월성 임상시험 디자인은 항생제의 경우에서는 윤리적으로 허용되지 않기 때문이다.
더불어서 비열등성 시험은 대부분 통계적 유의성을 확보하기 위해 대규모의 피험자를 대상으로 진행되기 때문에 비용이 많이 들어가나, 항생제 개발을 위한 임상시험은 현실적으로 비열등성 시험을 선택할 수 밖에 없는 실정이다. 그러나 새로운 항생제 신약의 비열등성 임상 시험의 경우, 새로 출현하는 병원균이나 기존 항생제의 내성균을 타겟으로 하는데 이러한 병원균에 감염된 환자를 모집하려면 타겟하는 내성균이 많이 퍼질 때까지 기다려야 하기 때문에 새로운 감염병에 대처하는 방법으로는 적절치 못하다. 소아과 환자 대상의 항생제 신약 하나는 6년에 걸쳐 임상 3상을 실시해야 할 정도로 환자모집에 어려움을 겪었다.
다. 항생제 개발의 경제적 가치 재고
앞서 이야기한 항생제 개발이 어렵긴 하지만, 성공시 뒤따르는 경제적 보상이 크다면 많은 제약사들은 여전히 항생제 개발을 위하여 고군분투하고 있을 것이다. 그러나 최근 조사결과를 보면 항생제 개발에 대한 경제성 평가는 아주 실망적임을 알 수 있다.
먼저 유럽의 통계를 살펴보면 평균 항생제 신약에 13년 정도의 개발기간 동안 $600 million이 지출되며, 출시 후 20년간 $2,500 million의 매출을 거두는 것으로 보고되었다. 그러나 미래의 매출액을 현재가치로 재계산하여 투자대비 매출액의 총 현재가치를 보여주는 NPV(Net Present Value)는 마이너스 $50 million 으로, 항생제 신약이 개발에 성공하더라도 5000만불의 손실을 가져다 준다는 결론이 나온다. 이러한 통계는 미국의 경우도 비슷하며 대부분 항생제의 경우 NPV 는 $40 million 이하이며 90% 가 마이너스를 나타내었다. 결국 이러한 분석에 의해 이윤을 목적으로 하는 제약회사는 항생제 개발을 아예 포기하는 것이 현명하다는 선택을 한 것이다.
2. 항생제 개발을 활성화 시킬 수 있는 방안
가, 전세계적인 지원방안
앞서 설명한 여러 가지 이유로 대형제약사를 비롯한 대부분의 제약회사들이 항생제 개발을 포기하고 있어 이를 극복하기 위한 전세계적인 지원 대책이 논의되고 있다. 일례로 유럽에서는 2011년 부터 ND4BB (No Drug for Bad Bugs) 프로그램을 실시하여 경제적 지원방안을 포함하여 Discovery 와 Development 분야의 7개 Topic 에 대해 데이터 허브를 구축하여 정보교류와 연구자들의 교육을 실시하고 있다. 또한 미국은 2012년 GAIN Act 를 발의하여 항생제 개발에 인센티브를 주는 방안과 FDA 의 규제완화방안을 구축하였으며 NIAID (National Institute of Allergy and Infectious Diseases) 에서 전임상과 임상 1상 시험을 지원해 주고 BARDA (Biomedical Advanced Research & Development Authority) 를 통해 산-학-연 공동연구를 지원해 주고 있다. 더불어서 새로운 항생제에 대해서는 국가에서 5년간 매년 $100 million 을 의무적으로 구매해 준다거나 항생제 개발회사에 대해 세금감면 등의 혜택을 제공하는 방안이 논의 중에 있다.
나. Pathogen-focused Labelling
항생제 개발의 어려움을 다소 완화 시키는 하나의 방법으로 최근 대두되고 있는 것이 pathogen-focused labeling 이다. 이는 기존 항생제의 Labelling은 특정 병원균에 의한 특정부위의 감염을 적응증으로 명시하고 있으나, 감염부위에 대한 제한을 없애고 특정 병원균에 대한 감염에 사용할 수 있는 것으로 명시하고 감염부위에 대한 자료를 첨부하는 형식으로 바꾸는 것이다. 이와 같이 바꾸게 되면 임상시험을 피부감염, 호흡기 감염, 요로감염에 대해 따로 실시할 필요가 없고, 그만큼 피험자 모집도 수월하게 이루어 질 수 있으며, 개발비용도 많이 줄일 수 있게 된다. 현재 이러한 처방은 유럽 EMA 에서는 일부 받아들여지고 있으나 아직 미국 FDA 에서는 아직 논의 중에 있다.
이러한 규제가 하루빨리 개선된다면 항생제 개발에 많은 활기를 불어 넣을 수 있을 것으로 기대된다. 특히 국내 식약처에서도 다양한 지원책과 Pathogen-focused Labelling과 같은 규제완화를 조기에 논의해서 실시한다면 항생제 개발을 위한 국내 임상시험이 더욱 활발히 진행 될 수 있을 것이다.
3. 맺는 말
2004년 미국 IDSA (Infectious Disease Society of America) 에서 “Bad Bugs, No Drug” 을 발표한 이후 2020년까지 10개의 새로운 항생제를 확보하자는 캠페인이 전개되었으나, 2013년 까지 새로운 항생제 단 한 개 만이 출시되었다. 그러나 최근 전 세계적인 항생제 개발지원책이 나오면서 올해 2014년에 MRSA로 대표되는 그람 양성균을 타겟팅하는 3개의 항생제가 FDA 허가를 받아 출시되었다. 이러한 분위기는 당분간 항생제 개발에 대한 규제완화와 인센티브 적용과 함께 더욱 가속화 될 것으로 보이나 아직 그람 음성균에 대한 약물 부족 현상은 아주 심각하다.

전세계적인 항생제 개발지원은 항생제 개발 회사에 큰 힘이 될 것으로 생각되며, 또한 이에 대응하여 국내의 항생제 개발 방향과 지원방안도 신속히 수립되어야 할 것으로 보인다. 만약 국내 식약처가 항생제 개발에 모범적인 지원방향을 내놓고 규제를 완화한다면 우리나라가 항생제 개발에 선구적인 역할을 할 수도 있지 않을까 기대해 본다.
끝으로 아직까지 힘든 항생제 개발에 종사하는 많은 분들께 진심으로 박수를 보내고 싶다.
We can‘t make companies develop new antibiotics
We have to make them want to develop new antibiotics