신약의 효율적 개발의 필요성과 중개의학의 도입
최승은
Director, Medical Affairs, South East Asia, Mundipharma, Korea
'효율적인 신약개발을 위하여 중개의학의 도입이 필요하다.'
근래 20년 가까이, 우리나라에서는 신약개발에 효율적인 투자가 이루어지게 되었다. 많은 노력과 협의 끝에 2011년, 범부처신약개발사업단이 출범하고, 향후의 투자방향과 타임라인이 셋팅되어 왔다
[1]. 다양한 전략의 도입으로, 10년 이상의 신약개발기간을 10년 이하로 줄이는 노력과, 투자를 효율적으로 하기 위한 전략들이 논의된 결과, 개량신약, 바이오시밀러 등 한국 현실에 맞는 다양한 방법들이 도출되고 응용되어 식약처의 허가를 받아내는 쾌거를 이루기도 하였다. 이 즈음하여, 다시 한번 신약개발의 목표를 구체화하고, 효율적인 투자, 그리고 개발방법을 도출할 수 있는 방안을 교환하고자 한다. 저자가 강조하고자 하는 신약개발의 목적은 허가 이후에도 고사되지 않는 신약개발이다.
정부 기관의 허가는 최소한의 유효성(Efficacy)과, 안전성(safety)이 검토된 신약을, 시장에 내놓는 과정이다. 시장에 나간 신약은 임상 및 치료과정을 통해서 전문가인 의사와 실제 구매자인 환자들로부터 지속적으로, 같은 질병에 적용되는 치료약들과의 경쟁적 검토를 받게 된다. 허가 후에 일어나는 일련의 과정들이 곧 개발되는 신약을 기다리고 있는 이 시기에, 보다 효율적으로 신약 발굴, 개발, 그리고 사후 임상 등의 전 과정을 아우르면서 그 틀을 제공하고 있는 중개의학의 중요성과 도입의 필요성을 소개하고자 한다.
1. 중개의학의 태동은 헬스케어 산업구조의 복잡성 때문이다.
중개의학, Translational medicine의 개념은 전문가들에 의하여, 빠르게 진화해오면서 현재는 T 또는 phase와, block의 개념으로 합의되어오고 있다
[2, 3]. 즉, 중개의학은 수많은 연구 활동 중에서, 의학적으로 충족되지 않고 있어, 새로운 치료법이 요구되는 영역의 치료법을 발굴하고 개발하는 과정의 의학이다. 중개의학이 대두된 이유는 보건의료환경 및 시스템의 복잡성에서 기인한다. 한 가지 치료법이나 약이 개발되어 환자에게 쓰여지기까지의 과정에 점점 높은 보건재정 및 사회비용이 요구 되어지자, 투자의 효율성을 높이는 측면에서 기업, 과학자, 의사, 그리고 정부관계자들의 논의아래 그 발전이 이루어져 왔다
[4].
2. 중개의학은 이행하는 연구내용과 시스템으로 구성된다.
중개의학은 연구내용과 연구내용을 아우르는 시스템으로 이루어진다. 중개의학의 연구내용은 의학적으로 아직까지 충족되지 않은 질병 및 치료법을 찾아내는 부분부터 시작된다. 이후, 수요에 맞는 물질을 정의하고 그 물질을 실험실적으로 재현 및 구현할 수 있는 지를 검증하는 발굴 단계를 거친다.
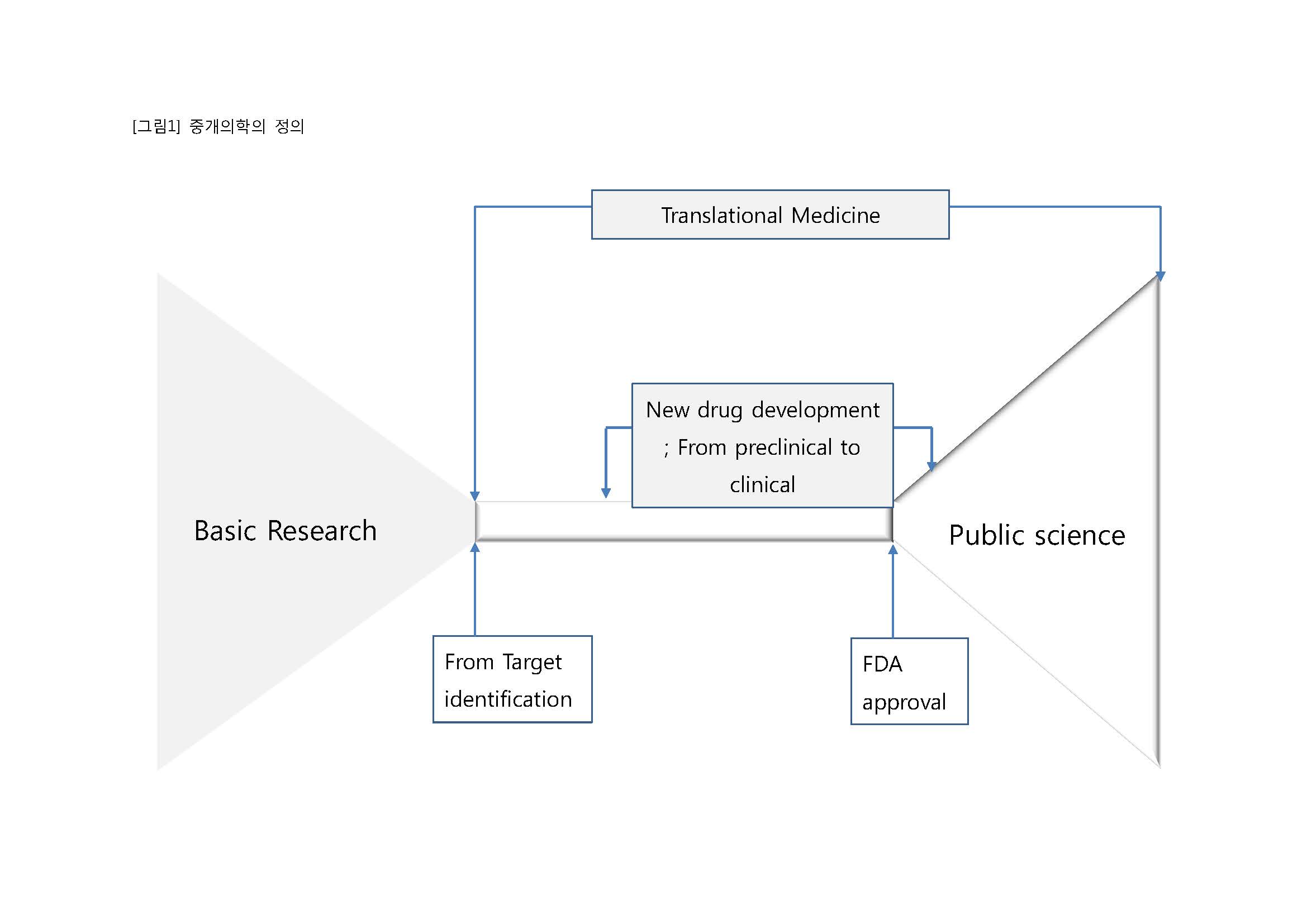
실험실적으로 발굴 및 재현된 물질은, 생체 독성과 유효성을 동물실험을 통해서 검증 받는다. 이를 중개의학에서는 전임상연구라고 부른다 [3]. 전임상을 거친 물질은 실제로 사람에게 활용될 수 있는지를, 통계, 생산, 제조, 전략 등의 논의를 거친 뒤에, 임상연구에 대한 정부의 승인을 얻고, 처음 사람 임상(First in Human trial)연구에 진입되고 이에 여러 단계의 임상연구 과정을 거쳐 물질 사용에 대한 정부의 승인을 받는 과정에 들어간다.
정부가 환자에의 사용을 승인한 후, 그 물질은 비로써, 보편적으로, 환자치료에 사용될 수 있다. 현재의 중개의학에 대한 정의는 보다 나아가 승인 후의 과학적, 임상적 활동도 모두 포함한다. 현재, 중개연구는 사람에게 중개되는 영역 T1이 first in human과, 1상 임상연구를 포함하며, 환자에게 중개되는 영역 T2는 임상 2상 연구와 임상 3상 연구를 포함하고, 실제 치료행위로 중개되는 영역 T3는 임상 4상 연구, 승인 이후 발생하는 모든 임상적인, 과학적인 연구를 포함하며, 보다 많은 인구, 공공의료화를 대상으로 하는 의료행위로 중개되는 영역 T4는 보다 대중적인 결정과 결정적인 가이드라인을 제시하는 의과학적, 역학적 연구활동을 포함한다
[5, 6].
중개의학은 다른 연구 영역과 달리, 시스템의 구축이 매우 중요하다. 중개의학은 반드시 임상에의 응용을 목적으로 하는 연구이기에 이에 수반하여 세가지 시스템이 발전해왔다. 한가지는 투자를 위한 시스템과, 두 번째는 연구 윤리를 위한 시스템, 세 번째는 규제 시스템이다. 이 세가지 시스템은 T각 단계로의 이행에서 중요한 결정요소로 작용하며, 각 지역의 규제 환경, 윤리환경, 그리고 투자환경에 따라 특징적으로 발달해왔다. 그럼에도 글로벌 스탠다드가 있으며 이 부분에 대해서는 다음 호에 상세히 기술하고자 한다.
3. 중개의학은 누가 주도하며 누가 참여하는가?
중개연구는 고전적으로는 약을 개발하여 시장에 내놓고자 하는 벤처 및 기업이 주로 중개의학을 주도해왔으나, 점점 학, 연에 종사하는 연구자, 정부 관계자들이 주체가 되어 중개연구를 진행하게 되고, 현재는 주로, 협업의 형태로 기업, 학교 및 연구소 병원, 그리고 정부, 환자들이 개발에 참여하고 있다. 이는 집단 지성의 활용과, 임상의사 역할의 중요성을 인정하게 되고, 효율적인 투자를 위한 사회적인 합의이다.
먼저 중요한 관계자로써 환자를 살펴보겠다. 헬스케어 산업에서 환자는 정보의 발달과 더불어 궁극적 구매자 뿐 아니라, 의사결정자로써의 역할이 점점 강화 되고 있다
[7]. 환자들은 중개연구 초반에서 의학적 미충족 영역에서 의사에게 적극적으로 의사를 전달하거나, 환자의 소유물인 생검 조직을 전문가인의사에게 위탁함으로써, 바이오마커를 개발하도록 돕는다. 또한 임상연구의 각 단계에서 자발적의지로 연구에 참여함으로써 윤리영역의 중요한 관계자이다. 신약의 허가 후에도 대규모 연구에 참여함으로써 중개연구의 성공의 키를 쥐고 있다고 해도 과언이 아니다.
헬스케어 산업계는 구성원면에서, 다른 산업계와는 매우 다른 특징을 가지고 있다. 환자는 약이나 치료법의 최종구매자로써 대가를 지불하지만 실제 선택행위는 의사를 통해서 한다. 환자는 지식적, 행위적으로 생산자와 평등한 위치가 아니기에 선택이라는 중요한 구매행위를 의사에게 위임하고 있는 것이다. IT의 발달로, 정보탐색이 수평적으로 이루어지면서 환자는 점점 더 많은 지식을 얻고 이에 직접적인 선택행위를 강화하고 있다.
고전적으로 정부 규제자는 환자들을 산업계에서 보호하고자 감시자 역할을 수행하였다. 그러나, 산업의 고도화에 따른 제품의 다양성과, 사회비용이 증가하면서 정부는 감시자 뿐 아니라, 의사결정자 역할을 강화하고 있으며, 정부의 의사결정에 전문성이 요구되면서, 의사, 과학자를 포함한 전문가들이 정부관계자로 활동하게 되었다
[8].
중개연구의 중요한 관계자는 이외에 과학자와 임상 연구자, 그리고 임상의사들이 있다. 과학자는 실험적 발굴 및 검증에서 역할을 하며, 임상연구자들과의 협업을 통해서 중개연구를 진행한다. 임상의사들은 T1 전 단계부터 비임상 영역에서, 질병에 대한 지식과 경험으로 실험의 방향성 설정에 중요한 역할을 하며, 임상연구를 담당한다. 기초 실험 및 임상연구에는 과학자와 임상연구자만 있는 것은 아니다. 기초연구를 둘러싼 많은 연구보조원, 그리고 기기보조원들은 실험의 정확성과 재현성의 가치를 더한다. 임상연구 모니터요원, 데이터 분석가, 전략가 등 구성원들이 임상연구의 질, 효율성과 윤리를 같이 진행한다. 중개연구의 처음과 끝은 치료행위를 하는 임상의사들에서 시작해서, 임상의사들과 환자들에 의해 평가 받고 치료방법으로 시장에 남을지가 끝으로 결정된다.
4. 한국에 중개의학이 필요한 이유
한국은 지난 10 여 년 간, 의과학에서 많은 발전을 이루어왔다. 특히 임상연구는 양과 질에서 전세계에서 주목을 받고 있다
[9]. 기초연구 또한 많은 발전이 있었고 기초연구가 활발해지면서, 세계적인 저널에 많은 한국인 과학자가 그 이름을 알리고 있다. 또한 각 병원, 연구소 등이 융합형 학술적 움직임을 시작하고 있다. 그러나 중개연구라는 시스템으로 의학적 미충족 영역을 발굴하여 신약을 마켓에 내보내는 전 과정이 한국에서 관계자들 사이에 협의되고 성공사례를 공유한 경우는 거의 보여지지 않고 있다. 효율적인 투자와 보다 많은 성공적인 신약개발을 이루고자 하는 민관협동 움직임인 중개의학을 도입함으로써, 내실을 다질 때라고 판단된다.
5. 중개의학은 미래에도 계속 된다
중개연구의 발전은 헬스케어 산업계의 특징인 복잡성에서 요구 되어지는 효율성, 생물체 및 인체실험을 포함하기에 요구되어지는 실험윤리, 그리고 환자라는 특수구성원을 고려한 의학적 윤리, 사회구성원의 고령화에 따른 보건의료비용의 증가에 따라 이루어졌으며, 중개연구의 미래 또한 이러한 요구를 더욱 만족 시키기 위한 방향으로 나아갈 것이다. 2007년부터 본격적 움직임이 시작된 in silico medicine은 computational biology 와 systemic biology를 중개연구의 한 축으로 받아들여, 현재 유럽에서는 in silico clinical trials을 현실화 하기 위한 road map을 진행하고 있다
[10]. 글로벌 움직임을 고려하여, 한국의 현실에 맞는 미래에 대한 고민이 필요한 시점이다.
'성공적인 신약개발을 위하여, 중개의학의 도입이 필요하다'
신약개발은 (1) 높은 투자비용이 요구되며, (2) 규제와 (3) 윤리라는 매우 특징적인 복잡한 산업계의 시스템 안에서 이루어지는 일련의 과정이다. 이에 협력을 중심단어로 하는 중개의학을 도입하고 구조화함으로써, 효율적이면서 성공률이 높은 신약개발을 이룰 수 있다.
이에 도입으로써, 중개의학에 대해 개론적으로 살펴보았다. 이러한 개론과 앞으로의 두 번의 각론이 의사에게는 본인의 신약개발에서의 중요한 위치를 다시 한번 각인하고, 가치 있는 임상경험을 보다 효과적으로 전달하고 발굴 및 개발에 적극 참여하는 기회를, 과학자들에게는 본인이 발굴하는 물질 및 방법의 질병치료에의 응용가능성 및 본인의 연구가 질병치료에 응용 되기 위한 단계들을 명확히 보여줌으로써, 협업을 유도하고자 한다.
또한, 규제전문가들에게, 규제라는 것이 중개연구시스템에서 어떤 역할을 하며, 현장에서 어떤 윤리가 규제와 같이 가는지, 또는 연구자와의 협업을 통한 규제 영역이 어떤 것인지를 확인 할 수 있는 기회를 제공하고자 한다. 마지막으로, 기업에서 일하는 중개연구관계자들에게는 기업의 전체 시스템에서의 본인의 역할의 중요성을 들여다 볼 수 있는 기회를 제공할 수 있는 작은 초석이기를 바란다. 궁극적으로, 이러한 내용들은 환자와 사회를 위한 것이라 확신한다.
[참고자료]
1. http://www.kddf.org/Main/
2. Littman B et al., What’s next in translational medicine?Clinical Science (2007) 112, 217–227 (Printed in Great Britain) doi:10.1042/CS20060108
3. Rubio D et al.Defining Translational Research: Implications for Training, Acad Med. (2010) March ; 85(3): 470–475. doi:10.1097/ACM.0b013e3181ccd618.
4. Woolf S. The Meaning of Translational Researchand Why It Matters. (Reprinted) JAMA,(2008) 299 (2), 211-213
5. Khoury M et al. The continuum of translation research in genomic medicine: how can we accelerate the appropriate integration of human genome discoveries into health care and disease prevention?, Genetics in Medicine (2007) 9, 665–674; doi:10.1097/GIM.0b013e31815699d0
6. ThorNicroft G et al. The place of implementation science in thetranslational medicine continuum, Psychological Medicine, Page 1 of 7. f Cambridge University Press 2011doi:10.1017/S0033291711000109
7. Evers M et al., Pharma Medical Affairs 2020 and Beyond, McKinsey & Company, 1-9
8. http://obamacarefacts.com/whatis-obamacare/
9. Shin S., The current status and policyof early stage clinical trials in Korea, ClinEval., (2011) 39(2), 367-375
10. http://avicenna-isct.org/
