단백질 의약품 개발 관점에서의 면역원성
이제욱, Ph.D., 오송첨단의료산업진흥재단 신약개발지원센터 책임연구원
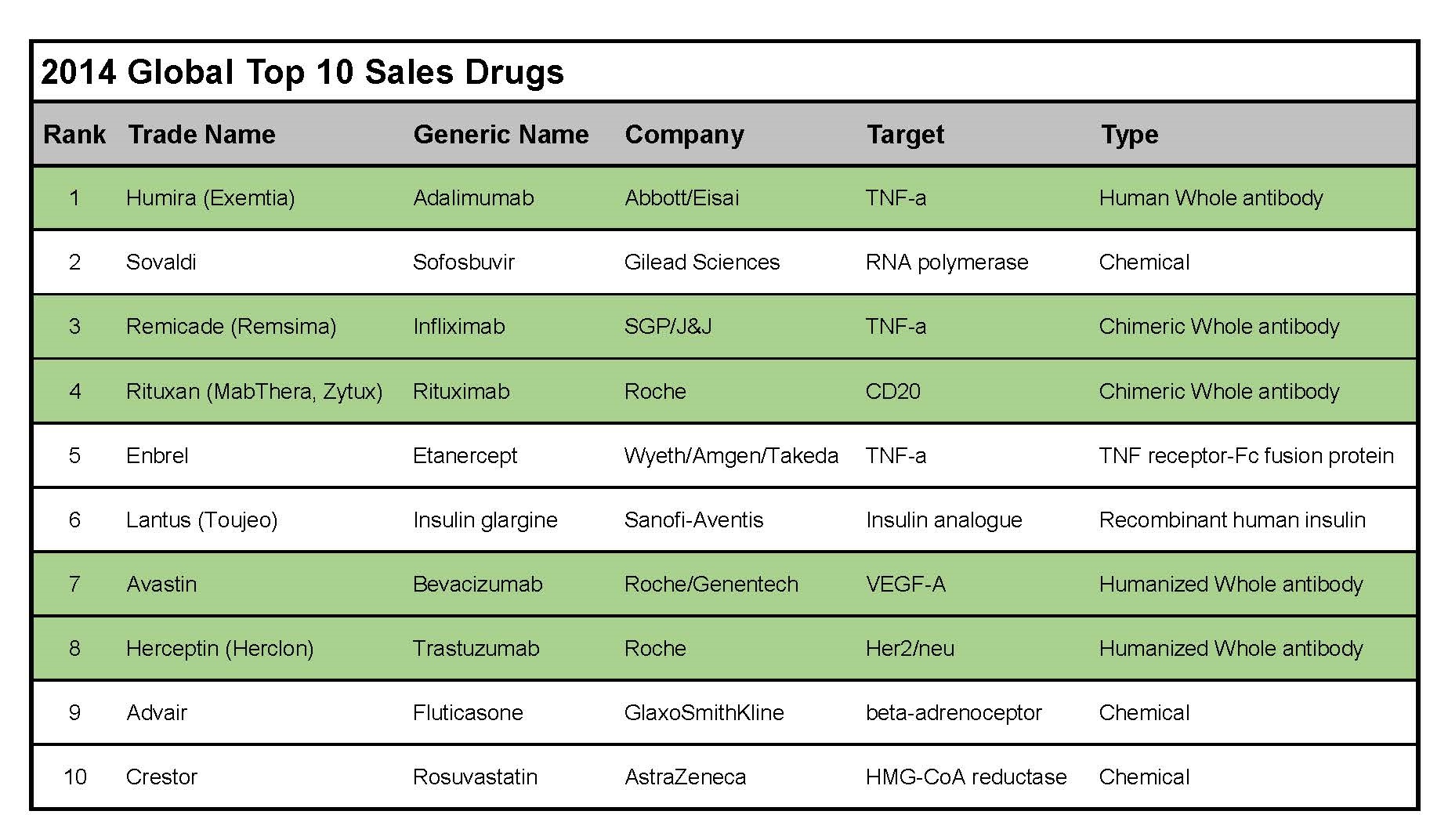
단백질 의약품은 인슐린, 성장인자, 항체와 같이 아미노산으로 구성된 의약품으로, 유전자치료제, 세포치료제, 백신과 함께 오늘날 바이오 의약품 시장에서 가장 중요한 위치를 차지하고 있다. 특히, 항체의약품은 2014년 전세계 매출 상위 10대 의약품의 50%를 차지하고 있다. 현재까지 합성 의약품은 전체 의약품 시장에서 여전히 중요한 위치를 차지하고 있지만, 항체 의약품은 높은 특이성과 낮은 부작용, 긴 체류 시간 등의 장점으로 인해 기존의 합성 의약품으로는 치료가 어려웠던 만성, 난치성 질환의 미충족 수요 (unmet needs)를 충족시킬 수 있는 대안으로 여겨지고 있으며, 그 비중은 지속적으로 증가될 전망이다.
반면, 단백질 의약품은 고차구조를 가진 고분자 물질로 저분자의 화합물에 비해 물리 화학적 안정성이 떨어지며, 생물체에서 생산하기 때문에 생물체의 종류나 배양 조건에 따라 단백질에 결합되는 수식물 (modifications)의 종류와 정도가 다양하여 동질성을 확보하기가 쉽지 않다. 이러한 이유로, 단백질 복제 의약품은 화학적으로 동일한 화합물과는 달리 단백질 서열과 효능을 제외하고는 물질 자체의 동질성 확보가 어려워 “Biosimilar”로 불린다. 단백질 의약품은 고분자 물질로 물리 화학적 불안정성과 생산 시 부가되는 수식물의 종류에 따라 체내에 유입되었을 때 다양한 면역반응을 유발할 수 있다.
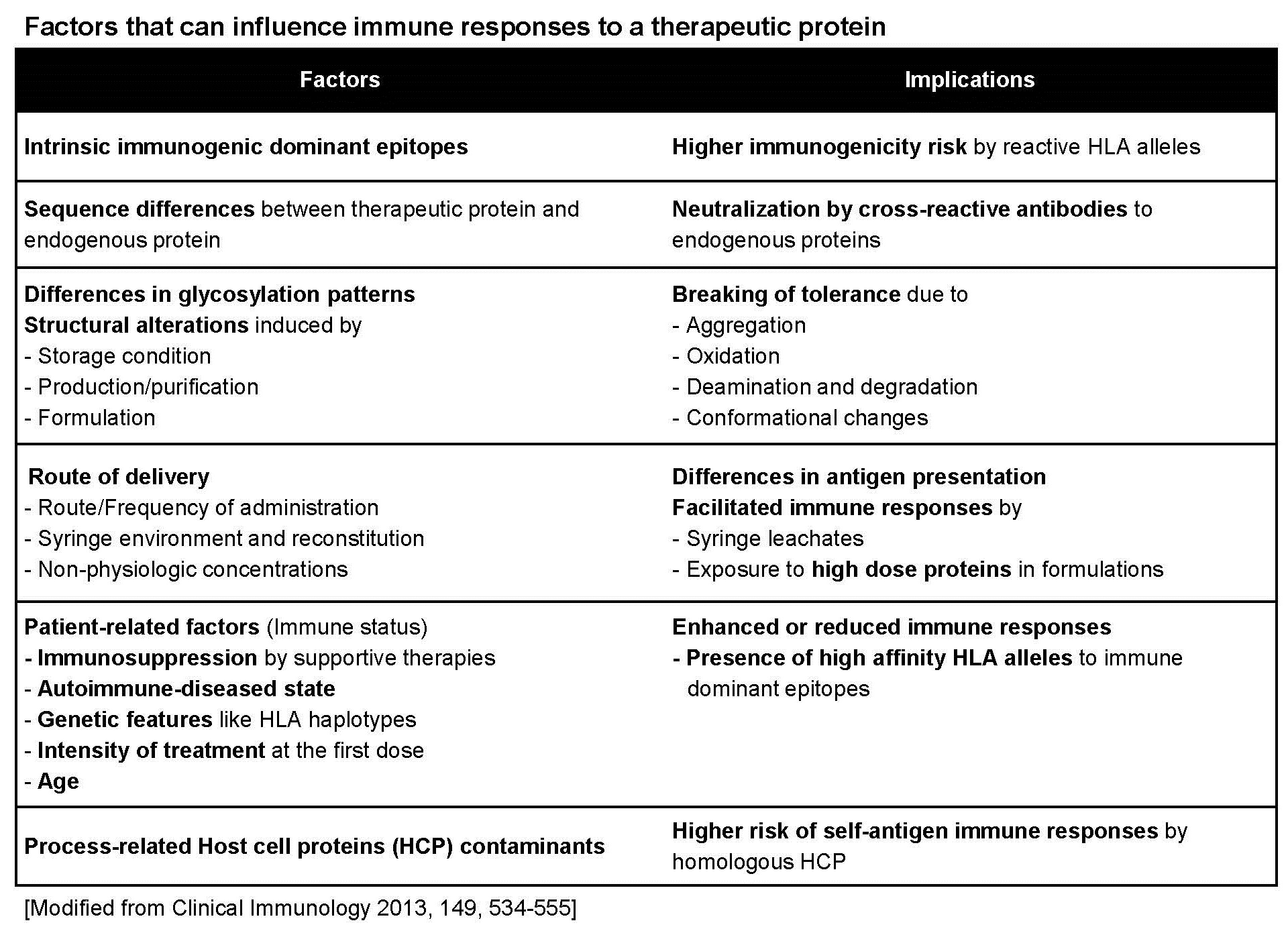
고분자의 단백질 의약품이 체내에 유입되었을 때 면역반응을 유발하는 성질을 면역원성 (immunogenicity)이라 하며, 크게 체액성 (humoral)과 세포성 (cellular) 면역반응으로 나뉜다. 면역원성은 체내에 유입되는 물질과 내재성 단백질과의 동질성 유무, 항원 결정인자 (epitope)의 유무, 당쇄 (glycosylation)의 차이, 생산/정제/제형/보관에 의한 구조적 특성이나 그 과정에 유입되는 외래성 불순물 유무, 투여 경로와 방법, 빈도, 환자의 면역학적 특성 (면역억제, 자가면역질환, 나이, 등), 유전학적 특성 (HLA 유형), 투여량과 농도 등, 다양한 약물 외적인 환경에 의해서도 크게 영향을 받는다. 단백질 의약품 투여로 인한 체내 면역반응은 약효뿐만 아니라 환자의 안전성에도 심각한 문제를 일으킬 수 있다. 특히, 생체내의 단백질과 서열이나 구조가 다른 단백질 의약품을 장기간 반복 투여할 경우 의약품에 대한 항체 (anti-drug antibody; ADA)가 만들어질 수 있다. 단백질 의약품에 대한 항체가 약효나 안전성에 아무런 영향을 미치지 않는 경우도 있지만, 약효를 상쇄시키는 중화 항체 (neutralizing antibody)는 약효의 소실은 물론 체내 체류 시간을 단축시키고, 급성면역반응이나 자가면역질환을 유발할 수도 있다. 따라서 재조합 단백질이나 항체와 같은 단백질 의약품 개발 시 면역원성 유발의 원인을 파악하고 개발 과정에 면역원성을 사전에 예방하고 최소화하는 것이 반드시 필요하다.
단백질 자체의 면역원성을 조사하는 방법으로는 in silico 기술을 활용하여 기존의 알려진 DB를 검색하여 matching을 통해 예측하는 방법과 Rosetta와 같은 프로그램을 사용하여 MHC II의 항원결합 부위에 대한 결합 가능성을 예측하는 기술이 사용되고 있다. 하지만 아직까지 in silico 기술의 정확도는 완벽하지 않아 실험을 통한 검증이 필요하다. 면역과 관련된 실험은 in vivo 모델이 다양한 면역계를 반영할 수 있지만 아직까지 사람의 면역계를 대변할 수 있는 실험동물모델이 존재하지 않고, 인간과 실험 동물 모델간의 면역시스템의 차이로 면역원성을 정확히 예측하기는 어렵다. 현재까지는 in silico 분석법과 사람의 말초혈액단핵세포 (Peripheral blood mononuclear cells)로부터 분화시킨 항원제시세포 (dendritic cells)와 CD4+ T세포를 사용한 in vitro immunogenicity 분석법을 병행하는 것이 면역원성 분석법의 신뢰도를 높일 수 있는 대안으로 제시되고 있다.
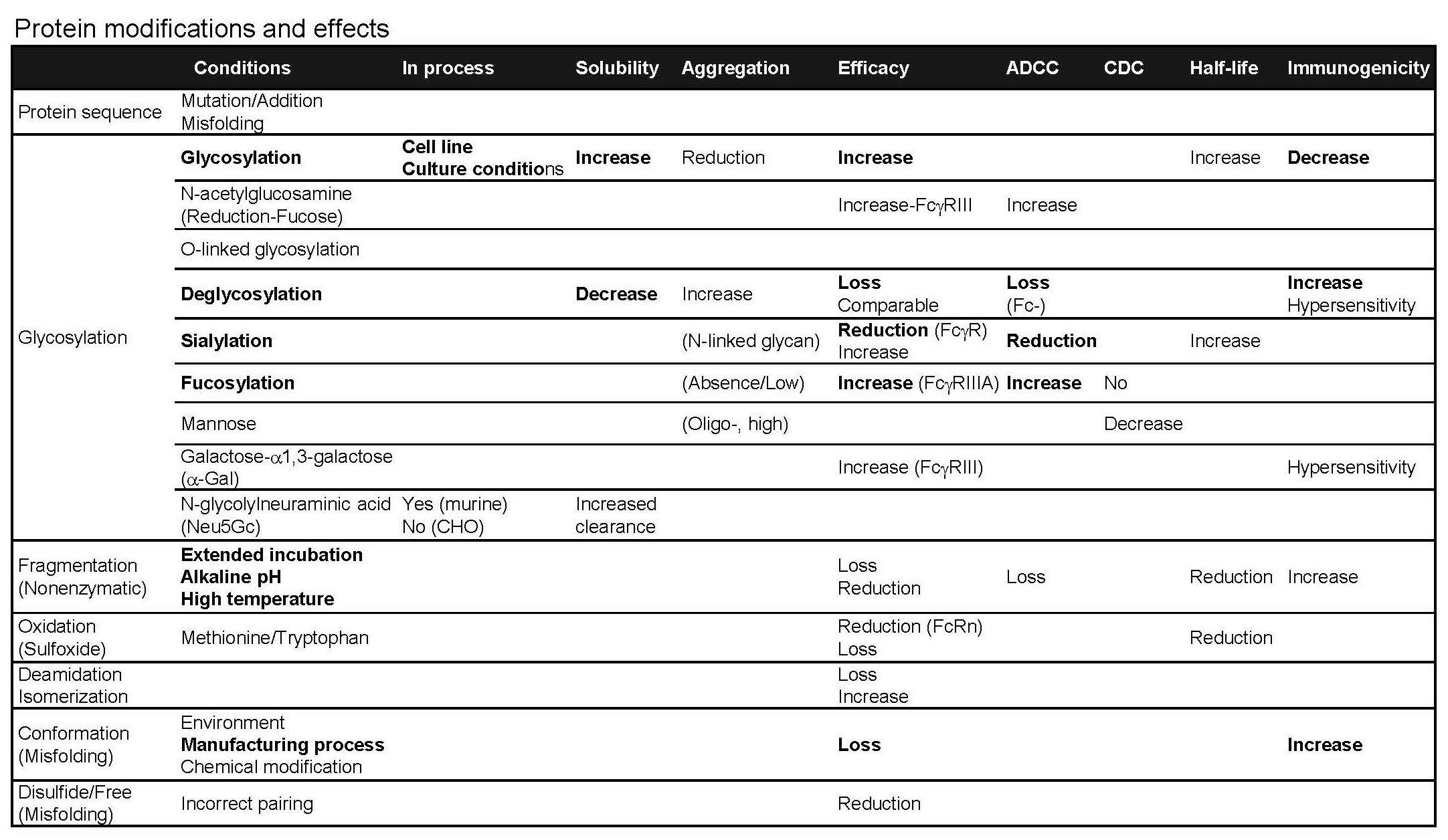
단백질 의약품이 인체에 투여 되었을 때 나타나는 반응은 환자의 생체 내 환경에 따라 달라질 수 있지만, 단백질 의약품 자체의 약효는 극대화하고 부작용은 최소화하는 전략이 필요하다. 단백질 의약품은 단백질 자체의 아미노산 서열과 생산 세포주, 배양 및 정제 조건 등에 따라 단백질에 결합되는 수식의 종류나 정도가 결정된다. 이러한 수식 (Modifications) 중에서 당쇄 (Glycosylation)의 종류 (Sialylation, Fucosylation, 등)와 유무에 따라 단백질의 물성, 효능, PK, 면역원성에도 영향을 미치기 때문에 개발하고자 하는 약물의 특성에 따라 맞춤형 개발 전략을 수립하는 것이 필요하다. 예를 들어, 항암제의 경우는 ADCC/CDC와 같은 cytotoxic effect를 극대화하도록 Fucosylation은 늘리고, Sialylation은 줄일 필요가 있는 반면, 지속형 (long-acting) 재조합 단백질 의약품은 반대로 ADCC/CDC effect를 최소화하고 반감기를 극대화할 수 있도록 Glycosylation과 Sialylation은 늘리고 Fucosylation은 줄이는 전략이 필요하다. 그리고 항체 의약품에서 가장 큰 문제가 될 수 있는 중화 항체를 유발하는 면역원성은 deglycosylation이나 fragmentation, misfolding에 의해 증가되며, 이러한 면역원성의 원인은 생산 공정을 최적화함으로써 최소화할 수 있음을 알 수 있다.
이와 같이 단백질 의약품은 단순히 아미노산 서열만 중요한 것이 아니라, 단백질을 수식하는 수식물의 종류에 따라 약물의 효능과 안전성에서 차이가 크므로, 개발 초기부터 이러한 관점에서 실험에 사용하는 물질을 생산하고 분석한 시료를 사용하여 다양한 실험을 진행해야 한다. 신약개발지원센터에 의뢰하는 대부분의 단백질 의약품은 SDS-PAGE나 gel filtration을 통해 순도 (purity) 정도만 확인하고 실험을 진행한 경우가 많아, 새로운 생산 세포주에서 생산한 후보물질과 이전 실험에 사용한 시료가 유사한지 조차 확인할 수 없는 경우가 대부분이다. 이러한 오류를 줄이기 위해 단백질 후보물질을 사용하여 본 실험을 진행하기 전에 후보물질의 순도, 완전성 (intactness), 당쇄의 종류와 정도 등은 반드시 확인하고 후속 연구를 진행하는 것이 필요하다. 그렇지 않으면 각 실험마다 완전히 다른 물질로 실험하는 오류를 범할 수 있어, 재 실험이 필요하거나 이미 진행한 실험 결과들이 의미가 없을 수 있다. 단백질 의약품의 특성을 이해하고 후보물질 생산을 위한 세포주 선정에서부터 생산 조건 등을 신중하게 고려하지 않으면 막대한 개발 비용과 시간을 낭비하는 결과를 초래할 수 있다.
신약 개발은 천문학적인 비용 (~€0.1B 이상), 장기간의 시간 (~10년 이상)과 노력이 필요함에도 불구하고 성공률은 그다지 높지 않다. 하나의 후보물질을 발굴하여 최종적인 의약품으로 시장에 출시되기 전까지 수많은 후보물질들이 개발 과정에서 효능이나 안전성 등의 문제로 중도 탈락한다. 개발 과정에 예측하기 힘든 다양한 이유로 수많은 후보물질들이 탈락하는 것이 개발 과정의 일부로 받아 들여지고 있지만, 개발 과정의 후반기로 갈수록 실패에 따른 시간과 비용 손실은 기하급수적으로 증가한다. 지금까지 밝혀진 과학적인 연구 결과와 신약개발 전체 과정을 고려하여 실패를 최소화하고 성공률을 높이기 위한 개발 전략이 필요하다. 합성 의약품 개발 과정의 화합물 최적화 과정은 물질 그 자체에 대한 최적화가 주류를 이루고 생산 과정은 개발 (Development) 과정의 일부인 반면, 단백질 의약품은 “후보물질의 최적화, 세포주 개발, 생산공정 개발을 포함하는 전체 공정 (Process) 자체가 의약품 (Product)의 일부”라는 인식의 전환이 필요하다.
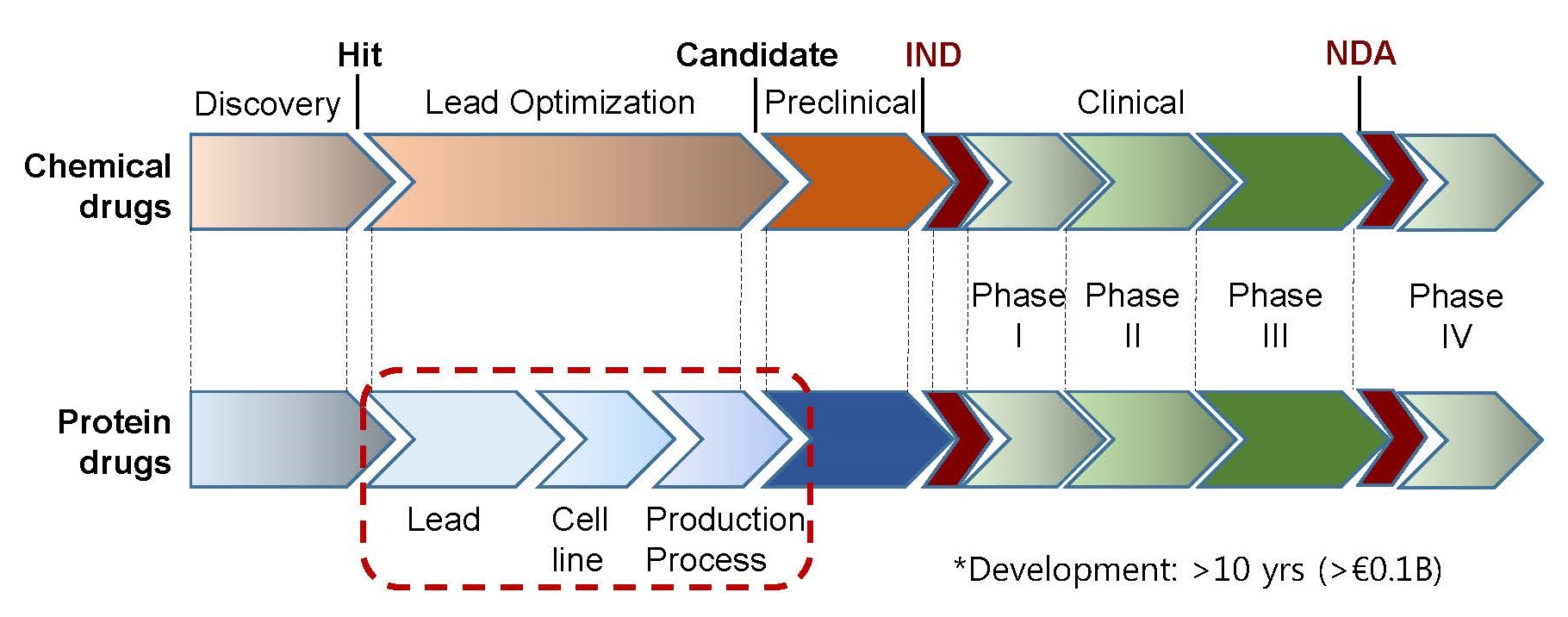
지금까지 바이오 의약품 중 항체와 같은 단백질 의약품의 개발 과정에 관여하는 다양한 인자들이 면역원성을 포함하는 약물성에 어떤 영향을 미치는지에 대해 알아 보았다. 신약개발의 성공률을 높이고, 산학연 연구자들의 결과물이 사업화로 이어지기 위해서는 후보물질 발굴에서 임상시험까지의 전체 과정을 고려한 중계 연구 (translational research)가 필요하다. 특히, “단백질 의약품은 아미노산 서열뿐만 아니라, 발현 세포주와 배지의 종류, 배양 및 정제 조건, 제형 (formulation)은 물론, 최종 제품의 운송 (Transportation)까지를 포함하는 전체 과정 (Process)이 단백질의 구조와 수식, 약효와 안전성에 영향을 미치는 의약품 (Product)의 일부”라는 인식이 반드시 필요하다. 오송첨단의료산업진흥재단의 신약개발지원센터 (
www.kbio.kr)는 이러한 바이오의약품 개발 지원을 위한 연구 시설과 장비, 전문인력을 갖추고 다양한 프로그램을 지원하고 있다.



