신약개발의 “히든 챔피언” 비임상 CRO
㈜바이오톡스텍 대표이사, 충북대 수의대 교수 강종구
2015년 세계 제약시장 규모는 1조 1000억달러로 추정되며, 국내 제약시장 규모는 약 2%인 190억달러 정도가 되는 것으로 알려져 있다. 이 같은 규모의 열세에도 불구하고 한미약품은 독자 개발한 “렙스커버리” 기술을 적용한 당뇨신약 퀀텀 프로젝트(Quantum Project)를 포함한 4건의 대규모 신약 기술수출에 성공하여, 수조원대의 기술 수출료를 받게 되어 국내 제약업계에 확실한 R&D 성공모델을 제시하였을 뿐 아니라 제약산업의 성공 가능성과 비젼을 제시한 한 해였다.
국내 신물질개발 R&D에 있어 가장 큰 걸림돌은 연구 인프라의 부족과 국내 인프라시설에 대한 인식 부족이다. 신물질, 특히 신약개발을 위해서는 동물을 이용한 효능 및 안전성을 평가하는 비임상시험기관과 사람을 대상으로 효능 및 안전성을 평가하는 임상시험기관이 필수적이다. 최근 국내 의료진의 기술력과 시설에 대한 우수한 평가가 이루어지면서 다국적 제약기업들이 국내에서 많은 임상시험을 실시하고 있으나, 대부분 국내 환자를 이용한 시험만 진행을 할 뿐 시료 및 데이터 분석은 자국으로 가져가서 실시를 하고 있다. 또한, 임상시험이 실시되는 대학병원에서 임상시험 전 과정을 관리 및 모니터링하는 기관도 국내에서 자생한 임상 CRO (Contract Research Organization, 수탁시험연구기관)를 이용하기보다는 외국계 임상 CRO를 이용하는 경우가 대부분이다. 사정이 이렇다보니 국내 임상 CRO의 성장 및 외국계 CRO와의 경쟁력 확보는 요원한 과제이다.
이 같은 상황은 비임상 CRO에도 그대로 적용되고 있다. 국내 제약사 경영자 및 연구자들의 대부분은 해외시장을 타겟으로 개발하고 있는 신약의 경우는 경험 및 비용의 문제로 개발 도중에 글로벌제약사에 기술 수출하여 동남아나 국내 시장만을 확보할 뿐이다. 글로벌 제약사에 기술수출이 목표이다 보니, 외국계 비임상 CRO를 이용하는 것이 훨씬 효율적이라는 생각을 하고 있다. 이 같은 생각이 틀린 것은 아니다. 그러나 최근에 기술 수출이 이루어지는 제품들의 개발단계를 보면, 대개의 경우 임상 1상 또는 임상 2a상이 종료되고 난 후에 이루어진다. 이 정도의 시험에 필요한 효능 및 독성시험은 국내 CRO들도 충분한 경험과 경쟁력을 가지고 있다고 확신한다. 국내 주요 CRO (안전성평가연구소, 바이오톡스텍, 켐온)들은 15년 이상의 경험을 가지고 있고, 미국 FDA의 GLP 사찰을 문제없이 통과한(안전성평가연구소, 바이오톡스텍) 실적이 있기 때문에 기술력, 데이터의 해석 능력, 개발에 필요한 컨설팅 제공 능력 등을 충분히 겸비하고 있다. 국내 CRO에 대한 막연한 불안감내지는 외국 CRO에 대한 맹신이 거액의 시험비용 및 개발 중인 신약에 대한 정보를 외국에 유출하는 우를 범하고 있다고 생각된다. 비임상 CRO의 주된 업무인 독성평가는 많은 시험경험과 데이터의 축적이 필요하나, 국내 제약사 및 바이오벤처들의 외국 CRO 쏠림 현상은 국내 비임상 CRO의 고사는 물론이고, 독성시험에 능통한 전문인력 확보에도 도움이 되지 못한다. 필자는 독성시험에 능통한 전문인력이 확보되지 못한 중소제약사나 바이오벤처들이 시험 도중에 생산되는 다양한 데이터에 대한 정확한 해석이 불가하여 신속한 의사 결정이 이루어지지 못하고, 이로 인하여 시간 및 비용을 낭비하는 경우를 많이 경험하였다. 장기적인 관점에서 본다면 당장은 경험이나 능력이 조금 부족할지 모르지만 국내 CRO를 활용하여 전문가를 육성하여 둔다면, 외국어가 아닌 모국어를 통한 소통과 동일한 가치 개념의 공유로 외국 CRO보다 훨씬 많은 시험외적 도움을 받을 수 있을 것으로 확신한다.
최근 CRO 산업은 신약 초기 연구단계와 전임상, 임상 1, 2, 3상시험, 데이터관리 등의 단순한 연구서비스의 제공을 넘어 제약사의 파트너로서 마케팅, 제조, 판매 등 “total CRO”로서 바이오산업과 함께 고성장을 하고 있다. 한 예로 미국 화이자의 비아그라의 경우는 개발업무의 50% 이상을 CRO에 위탁하여 실시하여 신약개발 기간을 7년에서 4년으로 단축한 바 있다. 따라서 신약개발의 성패는 적극적인 CRO의 활용과 CRO의 역량에 달려 있다 해도 과언이 아니다.
제약산업은 비용절감, 개발기간 연장, 약가압력, 특허만료, 블록버스터 부족, 새로운 제네릭 출시, 개인맞춤 치료제 등의 문제에 직면하면서 성장세가 정체되어 있다. 그러나 CRO 산업은 2015년 세계 CRO시장 규모가 327억 3000만 달러, 2021년 650억 달러 이상으로 성장할 것으로 예상되어 향후 5년간 50% 이상 성장이 전망된다. 이중 비임상 CRO의 규모는 전체 CRO 시장 중 약 17∼20%를 점유하고 있다. 한편, 국내 비임상 CRO의 규모는 2011년 기준으로 약 2,781억 원으로, 매년 34%의 성장세를 나타내고 있으며 2016년에는 7,009억 원으로 추정되어 전 세계 비임상 CRO 성장세를 상회하고 있다.
비임상 시험이란 사람에 대해 수행하는 임상시험 실시 전에 동물을 사용하여 안전성과 부작용을 예측하기 위해 수행되는 일련의 시험이다. 제약산업에서 비임상 CRO의 사업 영역은 합성의약품, 바이오의약품, 바이오시밀러, 세포치료제, 유전자치료제, 건강기능식품 등 인간의 건강과 안전에 관련된 신물질에 대하여 세포 및 동물 등을 이용해 효능과 인체유해성을 평가하는 연구개발 서비스사업을 포괄한다. 크게 나누어 안전성 평가, 유효성평가, 안전성 약리, 약물분석의 4개의 영역으로 나눌 수 있다.
안전성 평가는 신물질에 대한 독성 발현 및 부작용을 평가하는 것으로서 일반독성시험, 특수 독성시험 등이 해당된다. 유효성 평가는 신물질에 대한 약리학적 효과를 평가하는 것으로 스크리닝 시험, 약효약리 시험 등이 해당된다. 안전성 약리 시험은 약물개발 단계에서 치료용량 또는 그 이상의 용량에 노출되었을 때에 나타날 수 있는 바람직하지 않은 약리학적 효과를 평가하는 시험으로 심혈관계, 중추신경계, 호흡기계 영향에 대한 시험이 있다. 약물 분석의 경우 체내에서 약물동태 및 독성동태의 특성을 연구하는 것으로서 약물동태, 독성동태, 약동력학시험이 해당된다.
비임상 CRO는 이러한 신약개발 분야의 숨은 조연이자 “히든챔피언” 이라고 할 수 있다. 신약개발의 성공률은 1만분의 1 정도에 불과하지만 물질이 전임상시험을 무사히 통과하게 되면 성공률은 1/3~1/10까지 급격히 높아진다. 따라서 개발단계에서 가장 어려운 난관은 “죽음의 계곡”이라는 비임상 시험을 무사히 통과하는 것이며 이 과정에서 비임상 CRO의 역할은 매우 중요하다.
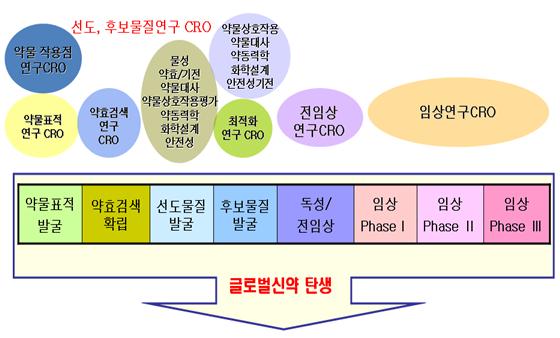
현재 국내 비임상 시험을 대행하는 GLP(Good Laboratory Practice)기관으로서 정부 출연연구소인 안전성평가연구소(KIT), 민간기업으로는 바이오톡스텍(Biotoxtech), 켐온(Chemon) 등의 CRO가 있다. 10년 전만 해도 국내 비임상 CRO 들의 기술력 및 경험 부족으로 비싼 비용과 기밀정보 누출의 위험을 감수하면서 Covance, Quintiles, Parexel, MPI 등 글로벌 CRO에 시험을 의뢰할 수밖에 없는 상황이었다. 이에 대한 도전으로 2005년 KIT가 미국 FDA의 GLP사찰을 받았으나 OAI를 받아 적격승인에 실패하였다. 이후 KIT의 2012년 12월 VAI(적격승인)을 시작으로, (주)바이오톡스텍은 2010년 12월 경제개발협력기구(OECD) GLP사찰단의 현지 방문평가를 국가대표 CRO로서 성공적으로 수행하였고, 2015년 1월 미국 FDA의 GLP실사를 단 한 번에 통과하였다. 이로써 우리나라는 미국 FDA GLP 적격승인을 받은 국제적인 인증기관을 2곳이나 보유하는 GLP 선진국이 되었으며, 국내 GLP기관에서 작성된 보고서가 미국 FDA나 유럽 EMEA에 허가자료로서 제출하는데 전혀 문제가 없게 되었다.
국내 비임상 CRO들은 대형 제약사의 R&D의 오랜 파트너로서 수많은 연구 경험과 노하우를 축적하여 기술적인 측면 이외에도 해외 CRO와 비교하여 원활한 커뮤니케이션, 빠른 대응에 따른 시험기간의 단축, 우수한 대관업무 협조체계, 신약관련 기밀자료의 해외 유출 방지 등 많은 장점을 보유하고 있다. 그러나 국내 비임상 CRO가 다국적CRO에 비해 해외 인허가 성공 경험과 해외 시장 진출을 위한 글로벌 경쟁력이 약하여 실패 확률이 높을 것이라는 두려움이 있으나 국내 CRO도 성장기에 접어들어 국제적인 CRO와 경쟁에서도 결코 뒤지지 않는 많은 장점을 갖고 있다. 바이오톡스텍의 경우에도 해외 매출이 20%이상이다. 따라서 국내 비임상 CRO사업은 한국형 신약개발 R&D 성공을 위해 가장 필요한 산업이다.
앞서 언급된 부분이 있지만 국내 비임상 CRO 활용에 따른 장점을 몇 가지 든다면,
첫째, 제약사 R&D 담당자와의 원활한 커뮤니케이션과 빠른 대응을 들 수 있다. 필자의 경험으로는 해외 CRO에 의뢰하여 커뮤니케이션의 어려움으로 진행상의 애로와 미스가 있어도 항의도 못하고 끌려가거나 약효와 독성의 오판, 임상증상과 조직병리소견에 있어서 스폰서의 의견이 충분히 반영되지 못해 실패하는 경우가 종종 있었다. 특히 해외 병리책임자의 경우 스폰서의 의견 조율을 통제하고 주관적인 판단으로 보고서를 발행함으로써 국내 업체에서 재시험하는 경우가 허다하였다. 반면 국내 CRO의 경우 독성시험을 진행하면서 문제점 발생 즉시 real time으로 시험에 대한 해결방안을 모색할 수 있는 장점이 있다.
둘째, 자사내 비임상 전문모니터가 없는 중소 제약업체 및 벤처기업의 경우 해외 CRO에만 맡기면 무조건 해결된다는 잘못된 인식이 팽배 되어 국내 업체에 재시험 하는 경우가 많았다. 해외 CRO에 의뢰하는 경우 스폰서 입장에서 독성이 있으면 안 된다는 우려로 지나치게 낮은 용량설정을 요구하여 NOAEL(No Observed Adverse Effect Level)설정이 어려워 First-In- Human(FIH) 1상에서 MRSD( Maximum Recomended Starting Dose)가 너무 낮게 산정되어 임상용량 범위를 축소하여 임상비용과 시간을 낭비하는 경우도 있었다. 반대로 스폰서가 물질의 안전성을 강조하기 위해 지나치게 높은 투여용량을 요구하여 NOAEL을 결정하지 못한 경우도 있었는데 CRO는 스폰서의 요구에 따라 시험을 수행할 뿐 그 결과는 스폰서의 책임이라는 것을 잊어서는 안 될 것이다. 또한 해외 CRO의 경우 컨설팅 하나하나가 엄청난 비용으로 스폰서의 추가 요구에 따라 비용이 증가하지만 국내 CRO의 경우 비용부담 없이 실시간 컨설팅을 통하여 다양한 방향으로 개발이 가능한 장점이 있다.
셋째, 국내 CRO을 활용할 경우, 원활한 커뮤니케이션 때문에 비임상시험 초기부터 우수한 국내 대학 병원의 임상의와 독성시험 초기단계부터 관찰된 결과를 실시간으로 분석, 검토하여 약물의 적응증에 바로 반영(translation)하여 개발방향을 실시간으로 수정함으로 시간 및 비용을 최소화 할 수 있다. 개발 초기부터 비임상은 물론 임상개발단계를 미리 예측하여 비임상 전문가와 임상의와의 유기적이고 통합적인 연계를 통하여 물질개발의 성공률을 높일 수 있는 장점이 있다. 아직 비임상 CRO를 개발파트너가 아닌 하청업체로 보는 국내 제약업계의 시선으로는 아직 이런 과정이 번거롭겠지만, 중개연구의 중요성을 인식하는 제약사 개발책임자의 의지와 열정에 따라 증개연구가 활성화 될 수 있다. 당사가 경험한 예로서 현재 미국 FDA의 1상승인을 받아 진행중인 블록버스터 신약후보 물질로 기대되는 (주)엔지켐생명과학의 EC-18(PLAG)의 경우 기초연구자, 비임상 전문가 및 임상의가 직간접적으로 수백차례에 걸친 논의를 통해 MOA 규명, 신규 적응증 개발 등 개발방향에 대한 논의가 이루어진 중개연구의 모범사례라 사료된다.
넷째, 국내 CRO의 경우 실시간적으로 다양한 효력시험과 및 질환동물모델을 이용한 비임상시험을 진행하면서 임상의와 협의를 거쳐 2상 및 3상에서 새로운 적응증 및 약효, 독성을 반영하는 바이오마커와 독성마커의 모니터가 가능하다. 인체의 종양조직을 이식하는 Xenograft시험의 경우 장기간 투여하는 만큼 항암효과와 독성시험을 병용한 시험 설계를 통하여 약효와 독성을 미리 예측할 수 있는 장점이 있다.
다섯째 , 국내 CRO는 세포치료제 등 첨단바이오 신약 연구에 있어 많은 연구 경험을 보유하고 있으며 특히 발육기 동물시험 (Juvenile animal studies, 소아독성시험)에 기술이 특화되어 있다. 소아독성시험은 “A child is not just a small adult” 라는 이슈 아래 미국, 일본 , EU에서 “소아를 대상으로 한 임상시험의 평가지침”이 발표되었고 소아용의약품의 제품개발 촉진을 위하여 임상시험을 위한 발육기동물시험의 필요성이 강조되었다. 발육기동물시험은 소아용 의약품 개발에 있어 필요한 비임상시험으로, 발육기 동물을 이용하여 반복투여에 의한 일반독성, 성장과 발달에 미치는 영향, 인지 및 운동성, 독성동태 등을 평가하는 시험이다. 기존의 약물 중에 성인에서 안전성이 확인된 약물 중에서 소아에 사용하기 위하여 발육기 동물시험이 수행되기도 한다. 투여기간은 임상에서 적용시기 및 표적장기에 따라 설정된다. 특히 랫드의 경우 영아, 신생아에 해당하는 시기(생후 1~4일)에 시험물질이 투여되기 때문에 정교함이 요구되는 고난이도의 시험이다. 또한 유약동물의 신경조직의 병리판독 기술이 핵심으로 해외 CRO에서 불가능한 시험이었으나 당사가 성공리 수행하여 해외 제약사로부터 많은 수주를 받고 있다.
세포치료제 연구에서는 우리나라는 특허 및 임상시험 건수, 기술력에서 세계 2위 수준이다. 이를 바탕으로 당사는 줄기세포치료제에 대한 풍부한 독성시험 경험과 다양한 투여경로와 세포취급 노하우를 축적하였다. 줄기세포의 독성시험 항목으로 단회 및 반복투여독성시험, 종양원성시험 및 체내분포평가시험이 있는데 국내 최초로 GLP적 프로세스를 확립하였고, Real-time PCR을 이용한 체내분포 평가•유전자치료제 체내분포 평가시험을 수행하고 있다.
끝으로 최근 신약개발의 활성화 방안으로 중개연구의 중요성이 부각되고 있다. 그러나 비임상 CRO사업을 15년이상 영위하고 있는 필자로서 중개연구가 아직 활성화 되지 못한 것이 아쉽다. 중개연구의 목적은 임상에서 개선이 요구되는 부분을 비임상적 방법을 통해 개선점을 증명하고, 이를 임상에서 확인하는 중개자적 역할이라 정의된다, 그러나 국내 최대의 비임상CRO의 경우에도 신물질 초기단계부터 개발의 방향과 의견 조율을 위해 비임상 연구자, 임상연구자, 기초연구자간에 의견 수렴의 기회는 거의 없었다. 제약사 R&D담당자는 비임상 CRO로부터 독성자료를 받아 임상의에게 전달할 뿐이고 임상진행 상황을 비임상 CRO에 통보한 경우는 극히 적었다. 신약은 최종적으로 사람에 적용되는 것이므로 임상의가 주체가 되는 것은 당연하지만 비임상 전문가가 바쁜 임상의를 만나는 것은 지극히 어려운 일이다. 아직 비임상 담당자는 임상에 대한 지식, 임상의는 비임상에 대한 기본적 지식이 부족하고 기초연구자는 기초에만 지식이 국한되어 중개연구의 효율을 높이고 성공을 위해서는 서로를 공유하고 조율하는 유기적인 협력의 장이 필요하다 생각한다.
국내 비임상 CRO의 많은 노력에도 불구하고 정부의 지원은 아직 미흡하다. 글로벌 신약개발 경쟁력을 위하여 미래부, 산통부, 복지부가 부처 간 R&D 경계를 초월해 추진하는 범부처 전주기 국가 R&D사업으로 범부처신약개발사업단(Korea Drug Development Fund. KDDF)을 발족하였지만, 국내 비임상CRO에 대한 지원책 및 배려는 전무한 현실이다. 또한 최근 미래부, 산통부, 복지부, 식약처가 주관이 되어 바이오헬스 미래 신산업 육성전략(2015. 3)을 발표하면서 해외 CRO에 대한 의존도를 낮추기 위해 국내 CRO의 기술개발 및 경험축적을 지원하여 국내 CRO의 글로벌 경쟁력 강화 방안 등을 강구하고 있지만 구체적인 지원방안은 아직 요원하다.
비임상시험에는 고도의 기술력과 노하우가 필요하며 담당인력의 기술육성을 위해서는 많은 시간과 비용이 소요된다. 비임상 CRO가 글로벌 수준의 경쟁력을 갖추기 위해 전문 인력의 안정적인 공급이 필요하다. 그러나 어렵게 육성된 비임상 CRO의 우수인력이 제약업체의 개발 담당자로 대부분 유출되고 있다. 제약사의 입장에서는 개발업무를 위해 숙련된 경험자를 활용할 수 있어 도움이 되지만 인력유출은 비임상 CRO의 경쟁력과 직결되는 부분이므로 정부의 대책 마련이 시급하다. 특히 신약개발 활성화를 위해 수행되는 정부 연구비 재원이 국민의 세금에서 지원되기에 국내 CRO의 육성과 발전에 기여해야 하는 책무가 있지만 해외 CRO의 선호 및 국내 CRO에 대한 차별이 큰 문제로 대두되고 있다.
국내 제약산업과 국내 비임상 CRO들이 글로벌 역량을 갖추고 균형적인 발전을 위해서는 CRO업계의 자구 노력도 필요하지만 국내 CRO에 비임상시험에 참여의 기회를 부여하여 동반성장하고자 하는 제약업계의 배려와 노력 그리고 정부 적극적인 지원이 수반되어야 할 것이다.
신약개발은 제약업계와 기초연구자, 비임상 CRO, 임상 CRO 모든 유관 분야가 조화를 이루어 발전해 나가는 “오케스트라” 이다. 신약개발의 잘 보이지 않는 부분에서 최대 조력자이자 국민의 건강과 안전을 지키는 지킴이로서 “히든 챔피언”의 역할을 수행하고 있는 국내 비임상 CRO에 대한 제약업계의 따뜻한 시선과 파트너쉽이 비임상 CRO 활성화의 원동력이다.
이전
2015.12.07
다음