항생제 내성균 대응을 위한 기술 개발 동향 및 산업화 전략 전망
- 진단 시약, 항생제, 마이크로바이옴 및 항체 치료제를 중심으로 -
박 순 희
(주)세바바이오텍 총괄연구소장
고려대 생물방어연구소 연구교수
성균관대 제약특성화학과 초빙교수
1. 항생제 내성균 대응 기술 개발
- 왜 우리가 특별한 관심을 가져야 하는가?
2. 항생제 내성균에 관한 WHO 등 국내·외 대응책 마련 동향
3. 새로운 항생제 국내·외 개발 동향
4. 진단시약, 항체 치료제 등 제품 개발 국내·외 동향
5. 마무리 글(저감화, 인류 생존 위기설의 주범)
6. 참고문헌
=============================================================================================
1. 항생제 내성균 대응 기술 개발, 왜 우리나라가 특별한 관심을 가져야 하는가?
감염성 질병 퇴치에 있어 백신과 함께 항생제는 인류의 수명 연장에 가장 큰 공헌을 해온 것으로 평가 받고 있다. 그러나 항생제는 그동안의 성과에도 불구하고 끊임없는 내성균의 증가로 감염병의 치료 효율이 낮아졌을 뿐만 아니라 어떠한 항생제에도 제어되지 않는 다제내성균(MDR: multidrug resistant microbes) 또는 슈퍼버그(superbug)가 출현으로(1, 2) 항생제 내성균과 인류는 그 끝을 알 수 없는 두려운 술래잡기를 하고 있는 상황이 되었다. 한편, 다제내성균의 출현뿐만 아니라 더 나아가서 내성인자가 mobile 플라스미드에 의해 미생물간에 이동이 더욱 쉽게 되었다. 그에 따라 사람 사이는 물론 국가 간에 급속히 전파 될 수 있음이 밝혀짐에 따라 항생제 내성균의 증가에 대한 우려가 크게 높아지고 있다.
올해 초, 미국 CDC는 미국에서 슈퍼박테리아에 감염된 환자가 미국에서 처방이 가능한 26개 항생제 모두에 내성을 가진 폐렴균에 감염되어 끝내 사망했다고 발표했고 이는 전 세계를 큰 충격에 빠뜨렸다(3). 이미 오래 전부터 항생제 내성균에 대한 대응 검토의 필요성이 제기 되어 왔지만(4) 이 네바다 여성 사망 사건은 국제적으로 더욱 경각심을 불러 일으켰다.
그동안 국제적으로 항생제 내성균에 관한 많은 분석들이 이루어졌다. 그 중에 중요한 것의 하나로 2014년 영국정부의 요청으로 경제학자 Jim O’Neill을 리더로 한 관련 위험과 경제적 분석이 광범위하게 진행된 점을 들 수 있다. 그 분석 결과가 2014년부터 9 편의 일련의 보고서로 발간되었다. 첫 보고서인 ‘Antimicrobial Resistance: Tackling a crisis for the health and wealth of nations, December 2014’에서는 전 세계를 놀라게 한 조사 결과가 보고되었다(아래, 보고서 리스트). 즉 2050년에는 항생제 내성균으로 인한 사망자가 모든 암발생 사망자보다 더 많은 연간 대략 1,000만 명에 이르러 인류의 재앙을 초래할 것으로 예측하였다(그림 1, AMR in 2050). 이에 전 세계가 경악하였고 국제적으로 긴급하게 효율적인 대응책 마련에 부심하게 되었다. 최종보고서는 2016년 5월에 발간되었으며(5). 이 보고서 발간 전후로 항생제 내성균에 대한 대응을 위해 구체적인 국제적 협력 추진 방향 수립 등 국제적으로 중요한 일들이 이루어져 왔다.
(보고서 리스트) 영국정부에 제출된 Jim O’Neill 팀의 보고서 리스트
• Tackling a global health crisis: Initial steps, February 2015.
• Securing new drugs: The pipeline of antibiotics, May 2015.
• Rapid Diagnostics: Stopping unnecessary use of antibiotics, October 2015.
• Safe, secure and controlled: Managing the supply chain of antimicrobials, November 2015.
• Antimicrobials in agriculture and the environment: Reducing unnecessary use and waste, December 2015.
• Vaccines and alternative approaches: Reducing our dependence on antimicrobials, February 2016.
• Infection prevention, control and surveillance: Limiting the development and spread of drug resistance, March 2016.
• Tackling Drug-resistant infections globally: Final report and recommendations, The review on antimicrobial
resistance chaired by Jim O’Neill, May, 2016.
(그림 1) 2050년 항생제 내성균에 의한 사망률과 타 질병과의 비교
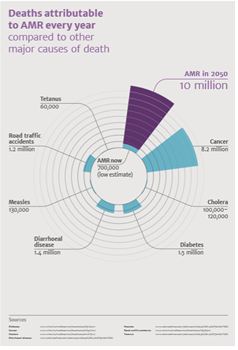
이러한 상황에서 마이크로소프트사의 창업자이자 빌앤멀린다게이츠재단(BMGF)의 공동이사장인 빌게이츠의 발언은 더욱 더 우리에게 항생제 내성균 관리의 중요성에 더욱 더 주목하게 한다.
빌게이츠는 올해 4월 영국왕립서비스연구소(RUSI: Royal United Services Institute, Independent Thinking on Defence and Security)의 초청 연설(April 19, 2017)에서 영국 등 선진국의 대외원조의 유지 확대만이 우리 인류의 생존율을 높일 수 있다고 언급했다. 특히 이러한 대외원조가 잘 이루어져야만 국제사회가 안정이 되고 테러가 감소될 것이며 국제사회가 이를 잘 이행하지 못할 경우 각국의 내부의 안정은 위협을 받고 ''바이오테러"가 증가할 것이라고 '경고' 하였다. 특히 바이오테러의 경우 이미 치명적인 병원균을 만들고 확산시키는 것이 그 어느 때보다 쉬워졌기 때문에 일 년 사이에 3천만 명 이상을 희생시킬 수 있는 생물학 무기를 이용하는 테러리스트 공격이 점점 더 증가할 것이라고 경고했다. 그는 지난 세기 인류에게 가장 치명적이었던 천연두나 인플루엔자보다 더 위험하고 핵공격보다 더 위험할 것이라고 언급했다. 빌 게이츠는 “오늘날 광범위한 세계여행으로 1919년 일 천만명이상을 숨지게 한 스페인 독감보다 미래 유행병이 더 치명적이다.. 앞으로 20년 안에 에볼라나 지카바이러스 보다 훨씬 더 나쁜 전염병이 생길 것이며 독감의 한 형태가 될 가능성이 있다”고 말했다(6).
Sarah Knapton은 빌게이츠의 RUSI 초청연설을 보도함과(7) 동시에 다음과 같은 내용을 보도했다. 2016년 Nuffield 생명윤리위원회(Nuffield Council of Bioethics)가 ‘차고과학자’(garage scientist, 차고에서 실험하고 연구하는 과학자를 지칭)가 위험한 유전자 변형체를 온라인상에서 구할 수 있는 환경을 조성하고 있다고 경고했던 점도 언급했다. 이미 유전자를 교정(Genome editing)할 수 있는 키트는 온라인에서 100파운드 미만으로 구입할 수 있는 상황이 됐다. 이에 따라서 과학자들은 유전자교정기술로 불리는 새로운 기술이 값싸고 어디서나 구할 수 있어 아마추어들이 집이나 학교실험실에서 실험을 시작할 것을 우려하고 있다. 이 기술은 유전자가위처럼 DNA코드를 자르고 그것을 새로운 유전자로 대체하는 것인데 현재 국내에서도 가장 중요한 과학적 돌파구로 여겨졌으나 테러범 등과 같은 나쁜 의도를 가진 사람의 손에서 위험한 박테리아나 다른 유기체의 변종을 일으킬 수 있다는 우려를 낳고 있다. 실제로 항생제에 대한 내성이 있는 대장균을 만들 수 있는 키트가 이미 인터넷상에서 판매되고 있다. 호흡기를 통해 사람에서 사람으로 감염되는 홍역이나 독감, 천연두에 감염된 사람이 버스나 비행기 공항에 단 한 사람의 감염자만 있어도 빠르게 전파되어 전 세계적으로 퍼져가는 큰 사건이 발생할 수 있다. 이제 ‘어딘가에서’의 보건위기는 ‘모든 곳에서’의 보건위기가 될 수 있다. 따라서 가장 무서운 것은 1919년 같은 유행성 독감과 같은 것이고 이제는 사람들이 이동하기 더 쉬워졌기 때문에 1919년보다 더 유행하기 쉬워진 것이다(8).
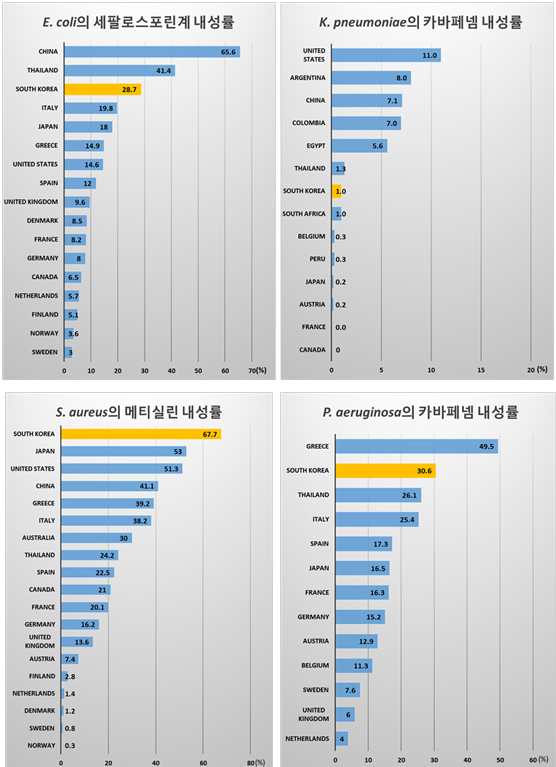
그럼 우리나라는 어떠한 상황에 있는가? WHO 보고(2014) 등에 의하면 우리나라는 항생제 사용률이 OECD 국가 중에서 상위에 속하면서 항생제 내성균의 검출도 상위에 속하는 위험한 상황에 있는 나라로 보고되고 있다(9, 그림 2).
그런데 2016년 12월 30일, 질병관리본부 보도자료에 의하면 민원의뢰 및 실험실감시사업으로 수집된 검체 가운데에서 분리된 병원체 중에서 2011년 이후 보관해온 카바페넴 내성 장내세균 9,000주 이상을 대상으로 콜리스틴 내성 검사와 MCR-1(mobile cholistine resistance) 유전자 존재 유무에 대한 확인 검사를 실시한 결과 국내 인체감염 항생제 내성 분리주 3개에서 MCR-1 항생제 내성 유전자를 확인하였다는 것이다. 또한 국내에서는 지난 8월 2013년-2015년 가축에서 분리한 장내세균에 MCR-1 유전자가 발견되었고(미국미생물학회(ASM) 간행지 ‘항균제 및 화학요법’ 발표(2016년 8월 29일), 2012년-2015년 임상검체에서 분리한 장내세균에서도 확인되어 국내에서도 MCR-1 유전자를 가진 장내세균이 가축 뿐 아니라 인체에도 전파될 수 있음을 보여줌으로서 그 심각성이 크다. 더욱이 발견된 MCR-1 유전자는 세포내 플라스미드에 존재하여 세대 간 전파뿐만 아니라 세대 내에서 동종 및 이종 세균 간에 쉽게 전달될 수 있어 공중보건학적으로 심각한 문제가 될 수 있다고 보도했다. 그런데 2017년 4월 5일 여러 보도자료에 의하면 젖소 원유에서 다제내성균 슈퍼박테리아 황색포도알구균이 발견되었는데 더 심각한 문제는 감염경로조차 파악이 잘 되지 않는다는 점이었다(10).
이러한 상황에서 특히 우리나라는 남북이 대치되어 있고 끊임없이 북한의 바이오테러 공격의 위험성에 노출되어 있는 상황이다. 따라서 세계 어느 나라보다도 가장 완벽한 항생제 내성균 관리 및 세균은 물론 나아가서 바이러스 질병을 포함한 관련 바이오테러를 예방할 수 있는 완벽한 시스템의 수립이 필요하다. 즉 어느 나라보다도 위험하고 긴급한 상황으로 항생제 내성균의 감소를 위한 모든 조처, 즉 단기적으로 항생제 개발은 물론 더 근본적인 해결방법으로 제시되어 있는 적절한 백신개발 시스템을 구축해야 할 뿐만 아니라 항생제 내성균 등을 활용한 바이오테러가 발생했을 경우 이를 조속히 해결하기 위한 모든 시스템, 즉 항체 치료제 등을 긴급 활용할 수 있는 시스템도 구축해 두어야 한다. 이와 동시에 바이러스 등을 활용한 바이오테러에도 대응할 수 있는 시스템이 통합적으로 구축되어야 한다. 이를 위해서는 먼저 항생제 내성균 관리 분야에서는 기술적으로 뿐만 아니라 시스템관리 차원에서도 국제적으로 follower가 아니라 leader가 되어야 하는 상황임을 직시해야 할 때이다.
(그림 2) 국가별 주요 항생제별 항생제 내성률 (출처: WHO report, 2014)
2. 항생제 내성균에 관한 국내·외 대응책 마련 동향
늦었지만 그래도 다행히 UN 등 국제기구가 Jim O’Neill 분석보고서등의 보고서에 반응하고 미국 CDC(11)와의 협력 등을 통해(미국 CDC 프로그램: The National Action Plan for Combating Antibiotic-Resistant Bacteria(2015 May) WHO를 포함 UN 산하기구인 FAO(Food and Agriculture Organization of the United Nations), OIE(World Organisation for Animal Health) 등이 공동 대응 방안(항생제 내성 대책 글로벌 행동 지침, GAPAR: Global Action Plan on Antimicrobial Resistance, Sixty-eight World Health Assembly in May 2015) 을 마련하였다(12, 그림 3).
5대 전략목표로 1.항생제 사용 및 내성에 대한 인식 개선과 경각심 고취, 2. 감시강화와 연구를 통해 지식 강화 3. 감염 저감화 및 항생제 사용의 적정화 4. 모든 나라의 필요에 대응하는 지속가능한 경제적 방안 마련, 5. 신약, 진단기술, 백신 그리고 그 밖의 적절한 조처를 마련하기 위한 투자 유도를 목표로 수립하였다.
(그림 3) 항생제 내성균에 대한 글로벌 대응 전략

이에 WHO와 국제사회는 제 1회 World Antibiotic Awareness Week(16–22 November 2015) 실시를 시작으로 다각도로 이 문제를 해결해 나가고자 다각도로 노력하고 있으며 또한 UN은 Resolution A/RES/71/3(Sep, 21, 2016)에 따라 IACG(‘ad hoc Interagency Coordination Group on Antimicrobial Resistance)를 구축하였다(https://www.un.org/sg/en/content/sg/personnel-appointments/2017-03-17/interagency-coordination-group-antimicrobial-resistance). 즉 UN과 WHO가 협력하여 항생제 내성균 문제를 해결해 나가기 위해 부단한 노력을 기울이고 있다. 그동안 WHO는 GAPAR을 마련하고 세부 추진 사업으로 GLASS(Global Antimicrobial Resistance Surveillance System) 프로그램을 2015년부터 추진해오고 있다. 그리고 2017년 2월에는 WHO가 항생제 개발 우선순위까지 발표하여 회원국들이 적극적으로 WHO GAPAR에 동참하여 목표를 달성해나가게 되었다(1) (http://www.who.int/antimicrobial-resistance/en/).
한편 앞서 언급한 바와 같이 우리나라는 WHO 등의 자료에 의하면 OECD 국가 중 가장 항생제 사용률이 높고 항생제 내성균의 검출률도 높은 나라이다. 따라서 향후에도 내성균 검출 증가가 크게 우려되는 국가 중 하나이다.(그림 2. 국가별 항생제 내성률 비교). 다행히 우리 정부는 WHO가 coordination하는 GLASS 프로그램에 2016년도에 참여하고 그 후속조처를 하나씩 이행해 나가고 있는 상황이어서 조금은 안도의 숨을 쉴 수 있는 것으로 보인다(10).
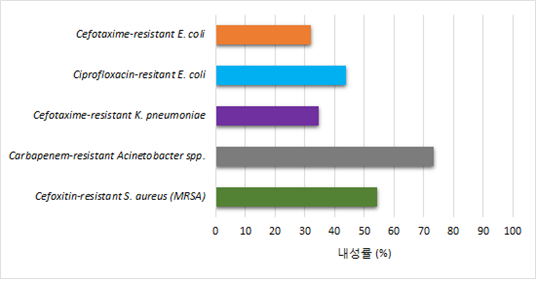
그런데 2017년 4월 5일자 JTBC(http://news.jtbc.joins.com/article/article.aspx?news_id=NB11449973) 등 여러 보도자료에 의하면 국내에서 젖소 원유에서 황색포도상구균의 슈퍼박테리아가 검출되었는데 문제는 감염경로 조차 파악이 안되는 사태가 발생한 것이다. 또한 2017년 7월 5일 보건복지부 보도자료에 의해 다시 한번 더 우리나라의 항생제 내성균의 심각성을 적나라하게 알 수 있게 되었다(2017년 7월 5일 보도자료, 그림 4). 질병관리본부/ 국립보건연구원은 GLASS에서 요청하는 표준화된 자료를 산출하기 위해 6개 권역(서울, 경기, 강원, 충북, 전남, 부산)의 종합병원을 감시기관으로 지정하여 환자로부터 분리된 8종의 감시 대상 병원체(대장균(Escherichia coli), 폐렴막대균(Klebsiella pneumoniae), 아시네토박터균(Acinetobacter spp.), 황색포도상구균(Staphylococcus aureus), 폐렴알균(Streptococcus pneumoniae), 살모넬라균(Salmonella spp.), 세균성이질균(Shigella spp.), 임균(Neisseria Gonorrhoeae)병원체에 대한 항생제감수성 검사와 내성유전자 특성 조사 등 실험실감시를 ’16년 5월부터 수행한 결과 총 10,586주(균체 단위)를 수집, 분석하였다. 주요 병원체의 내성률(그림 4)을 보면 대장균의 43.9%가 ciprofloxacin, 32.1%가 cefotaxime에 내성이었으며 폐렴막대균의 34.5%가 cefotaxime에 내성이었다. 또한 아시네토박터균의 경우 73.4%가 carbapenem에 내성이었고, 황색포도상구균의 54.3%가 MRSA(메티실린 내성 황색포도상구균)로 확인하였다.
그리고 바로 이번 달 8일 질병관리본부 감염병웹통계시스템에 따르면 기존의 항생제가 듣지 않는 '슈퍼박테리아'에 대한 전수감시가 시작된 지 두 달 만에 전국 병원에서 항생제 내성균인 카바페넴 내성 장내세균속 균종(CRE) 신고 건수는 전수감시가 시작된 지난 6월 3일부터 8월 7일 현재까지 1천 717건이 신고되었다.
CRE는 2011년 100여개 의료기관을 통해 표본감시를 시작했을 때 10개 미만의 기관에서 신고가 접수됐지만 5∼6년이 지난 최근에는 40여개 기관으로 퍼졌다고 한다 (http://www.yonhapnews.co.kr/bulletin/2017/08/08/0200000000AKR20170808041500017.HTML?input=1195m; https://is.cdc.go.kr/dstat/index.jsp). 이러한 심각한 상황을 보면 우리나라가 항생제 내성균에 대해 더욱 적극적 대응을 해나가야 할 것을 명백히 보여주고 있다(11, 12).
(그림 4) 우리나라 항생제 내성균 (’16년 5월~’17년 4월) 출현율(2017. 7. 5. 보도자료)
그동안 정부의 조처에도 불구하고 우리나라는 감염성 미생물, 특히 항생제 내성을 지닌 감염성 세균을 이용한 바이오테러의 위험이 가장 높은 국가임으로 다른 어느 국가보다 더 체계적이고도 적극적인 대처방안을 구축해야 할 것으로 생각된다. 즉 긴급 상황시 대응방안으로 항생제 외에도 대체 치료제 등을 확보할 수 있는 확보 생산, 관리 시스템의 신속한 구축이 필요한 것으로 판단된다.
이에 본고에서는 2016년 정부가 총리 주재 국가정책조정회의(2016. 8. 11(목)) 회의결과로 확정 보도한 ‘국가 항생제 내성 관리대책(2016-2020)’ 내용 중 항생제 내성균의 관리 대책이 산업과 직접 관련이 있는 부분인 목표 5. (신약, 진단기술, 백신 그리고 그 밖의 적절한 조처)와 관련된 항생제 개발, 진단 시약 및 항체 치료제 개발 등의 순서로 국내·외 개발 동향에 대하여 살펴보고 Health Security를 넘어서 산업진흥에도 크게 기여할 수 있는 방안을 마련하는데 기여하고자 한다.
3. 새로운 항생제 개발 동향
- 우리에게 기회는 있는가?
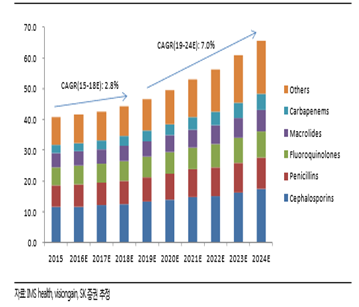
IMS Health 등에 의하면 항생제 세계 시장 규모는 2017년 40.0 b$ 이상일 것으로 예상하였으며 2018년 이후 연평균 7.0% 성장률로 2024년 60.0 b$에 이를 것으로 전망되고 있다(노경철의 ‘빅파마가 다시 뛰어드는 항생제 시장’에서 인용) (그림 5).
(그림 5) 글로벌 항생제 내성균에 대한 항생제 시장 전망, 단위 bn$, 노경철, 2016
(그림 6) List of bacteria for which new antibiotics are urgently needed, WHO report Feb. 27, 2017

한편, UN과 WHO 등이 항생제 내성균 발생의 심각성에 대하여 새로운 항생제 개발을 포함한 범세계적, 각국 대응 방안 마련을 촉구하면서 WHO는 2017년 2월 긴급히 개발되어야 할 새로운 항생제 목록을 발표했다(13~15).
이에 의하면 신규 항생제 개발이 요구되는 심각, 상위 위험, 중위 위험 군의 세 군으로 나누어 대응 방안 모색을 제시하였다. 이와 동시에 지속적으로 신규 항생제에 대한 내성균이 발생할 우려가 크므로 이에 대한 다른 비 항생제 적 치료제 등 치료 방안 모색도 권고하고 있다(WHO priority pathogens list for R&D of new antibiotics; Priority 1: CRITICAL; 1.Acinetobacter baumannii, carbapenem-resistant, 2.Pseudomonas aeruginosa, carbapenem-resistant, 3.Enterobacteriaceae, carbapenem-resistant, ESBL-producing; Priority 2: HIGH, 1.Enterococcus faecium, vancomycin-resistant; 2.Staphylococcus aureus, methicillin-resistant, vancomycin-intermediate and resistant, 3.Helicobacter pylori, clarithromycin-resistant, 4.Campylobacter spp., fluoroquinolone-resistant, 5.Salmonellae, fluoroquinolone-resistant, 6.Neisseria gonorrhoeae, cephalosporin-resistant, fluoroquinolone-resistant, Priority 3: MEDIUM, 1.Streptococcus pneumoniae, penicillin-non-susceptible, 2.Haemophilus influenzae, ampicillin-resistant, 3.Shigella spp., fluoroquinolone-resistant)
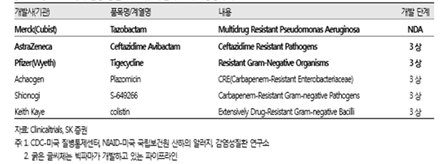
항생제의 국내외 개발동향은, 2016년(6월) 발간된 ‘빅파마가 다시 뛰어드는 항생제 시장, 노경철 저’를 참조하면 좋을 것이다(13). 동 자료는 관련 동향에 대해서 광대한 자료를 확보, 제시하고 있다, 동 자료에 의거하면 일반항생제 개발은 임상 2상 이상에 진입되어 있는 건만 하여도 그람양성균 35건 그리고 그람음성균 20건이 있다. 그리고 항생제 슈퍼내성균에 대한 개발 건만 하여도 2016년 보고 당시 아래 표 1, 2에 제시되어 있는 바와 같이 미국 FDA의 NDA에 들어가 있는 것만 하여도 3개, 그리고 IND이상은 그람양성균 19건 그리고 그람음성군 3건 이상이 진행되고 있다. 국내 제조사로서는 유일하게 크리스탈지노믹스의 Gram Positive 슈퍼항생제(CG400549, FDA 2 상 a 완료)가 포함된 것으로 보고된 바 있다. 더 자세한 국제 및 국내 항생제 개발 동향은 노경철의 ‘빅파마가 다시 뛰어드는 항생제 시장’ 원문과 아래 표 1, 2를 참고하면 도움이 될 것이다(16).http://medipana.com/news/news_viewer.asp?NewsNum=205366&MainKind=A&NewsKind=5&vCount=12&vKind=1
(표 1) 미국 FDA에 IND를 통해 임상시험 중인 항생제 내성균 Gram(+) 대상 주요 항생제(16)

(표 2) 미국 FDA에 IND를 통해 임상시험 중인 항생제 내성균 Gram(-) 대상 주요 항생제
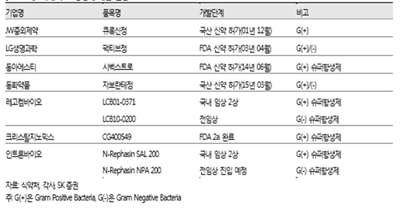
우리나라의 항생제 개발 현황을 보면, 국내산 신약이 4 건 출시되었고 그 중에 FDA 신약으로 허가 받은 의약품이 2개 있다. 현재 개발 중인 주요 신약 후보로는 레고켐바이오의 Gram Positive 슈퍼항생제(LCB01-0371, 국내 임상 2상), 크리스탈지노믹스의 Gram Positive 슈퍼항생제(CG400549, FDA 2 상 a 완료), 인트론바이오의 Gram Positive 슈퍼항생제(N-Rephasin SAL 200, 국내 임상 2상) 등이 있다. 레고켐바이오 의 LCB01-0371 는 경쟁 약물 대비 안정성을 크게 끌어올린 Best-in-Class 품목이고, 크리스탈지노믹스의 CG400549, 인트론바이오의 N-Rephasin SAL 200은 기존에 없던 혁신적인 치료제 방식의 First-in-Class 약물이다. 이외에 레고켐바이오와 인트론바이오는 강력한 Gram negative 슈퍼항생제를 전임상 중에 개발하고 있다. (빅파마가 다시 뛰어드는 항생제 시장, 2016, 노경철, SK 증권사).
(표 3) 국내 주요 항생제 개발 동향(17)
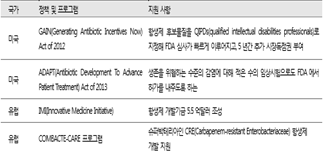
즉 다국적기업들과 미국 등 선진국은 '슈퍼박테리아'를 이기기 위한 항생제 개발을 도전적으로 진행하고 있음을 알 수 있다. 특히 미국의 경우 항생제 내성으로 인한 위기를 해결하기 위해 2012년부터 항생제를 개발하면 신속 허가와 시장독점권과 같은 인센티브를 제공하고 하는 '항생제 개발 촉진법(GAIN Act)'을 시행하고 있다. 지금까지 미국에서 새로 개발돼 감염질환인증제품(QIDP, Qualified Infectious Disease Product)으로 출시된 항생제가 5개 이상이다. http://cddep.org/blog/posts/recent_fda_antibiotic_approvals_good_news_and_bad_news#sthash.uVHOmWym.dpbs 미국 외에도 선진국들은 항생제 내성균 대응을 위한 적극적인 정책이 이미 수년간 진행해 오고 있다(표4). 그러나 우리나라는 아직 선진국처럼 적극적인 개발 지원책이 체계적으로 수행되고 있지 않다. 더욱이 미국 등에서 개발된 제품조차 아직 국내에서 적절히 시판 및 사용되고 있지 않아서 사용이 아직 제한적인 상황이라고 한다(표4) 슈퍼박테리아' 이기는 新항생제, 한국서는 그림의 떡?, 메디파나뉴스, 박으뜸, 2017-08-14) (http://medipana.com/news/news_viewer.asp?NewsNum=205366&MainKind=A&NewsKind=5&vCount=12&vKind=1)(16)
(표 4) 주요 국가의 항생제 개발 지원 정책(17)
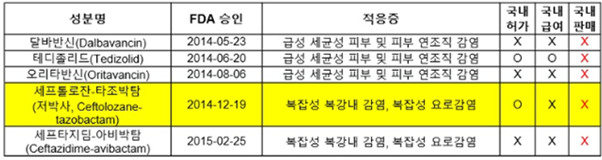
즉 국내에서 이 슈퍼박테리아를 이길 수 있는 항생제 내성균에 대한 치료제, 진단제 등을 체계적으로 개발하는 시스템이 아직은 수립되어 있지 않은 것으로 보인다. 국내에서도 슈퍼박테리아, 다제내성균에 대한 항생제 개발에 대한 미국의 GAIN 프로그램처럼 초기 개발부터 더 적극적인 지원책이 마련되어야 할 것으로 보인다. 그러나 일회성의 프로그램이 아닌 기초, 개발, 허가, 보험 등을 포함한 일련의 제품개발이 거시적으로 관리 지도 할 수 있는 시스템의 구축이 필요하다. 즉 전례가 없는 특별 사업단 형식으로서 소위 치료가 불가능한 환자들에 대한 Unmet needs의 해결뿐만 아니라 바이오테러의 Health threat부분까지 통합적으로 진행될 필요가 있다.
(표 5) 미국에서 2012년 항생제 개발 촉진법 시행 이후 승인 받은 항생제와 국내 허가 및 판매 여부, 메디파나뉴스, 박으뜸, 2018, 8.14.
4. 항생제 개발 외 항생제 내성균 제어를 위한 제품 개발 국내외 동향
- 진단시약, 마이크로바이옴, 항체 치료제 등 제품 개발 국내외 동향
최근 몇 년간 선진국을 중심으로 상기와 같이 새로운 항생제의 개발이 지속적으로 이루어지고 있는 것을 알 수 있다. 그러나 이미 언급한 바와 같이 새로운 내성균이 빠른 속도로 출현하므로 항생제 개발만이 최선의 방책이 아니다. 특히 초기의 항생제 내성균의 출현속도보다 최근 그 출현속도가 급속히 빨라지고 있다(표6). 이와 같이 처방된 항생제의 내성균에 대한 새로운 항생제의 개발이 지속적으로 요구되고 있다. 동 상황은 잠자는 토끼와 달리는 거북이의 경쟁이 아닌 시지프스의 신화에 비교되는 불행한 경쟁이 되어버린 것이다. 이에 따라 WHO Global action plan for antimicrobial resistance의 R&D 목표에서는 다음과 같이 새로운 치료제, 진단기술, 백신, 마이크로바이옴, 항체치료제 등 다른 제어법들의 개발에 투자가 되어야 한다는 점을 강조하고 있다. 즉 R&D and investment: Objective 5: Develop the economic case for sustainable investment that takes account of the needs of all countries, and increase investment in new medicines, diagnostic tools, vaccines and other interventions.
(표 6) 주요 항생제의 내성 출현 시기의 비교

따라서 항생제 개발에 더하여 보다 더 체계적이고 근본적인 대응방법이 요구되고 있다. 상기 WHO가 언급한 백신 외에도 alternative intervention으로서 제시되고 있는 것들이 있는데 그 예로서 미국 CDC의 항생제 내성균 대응 해결 전략(그림 7), 그리고 짐 오닐 팀에 의해 영국정부에 제시된 대체제품들(그림 8) 등이 새롭게 제시되고 있다.
(그림 7) 미국질병관리본부의 항생제 내성 해결 전략

미국 CDC 전략(그림 7)은 기 설명한 WHO나 영국정부에 보고된 짐 오닐팀의 자료와 유사하게 제시되고 있다. The goals of the National Action Plan include: 1. Slow the Emergence of Resistant Bacteria and Prevent the Spread of Resistant Infections. 2. Strengthen National One-Health Surveillance Efforts to Combat Resistance. 3. Advance Development and Use of Rapid and Innovative Diagnostic Tests for Identification and Characterization of Resistant Bacteria. 4. Accelerate Basic and Applied Research and Development for New Antibiotics, Other Therapeutics, and Vaccines. 5. Improve International Collaboration and Capacities for Antibiotic-resistance Prevention, Surveillance, Control, and Antibiotic Research and Development. 다만 특별히 눈에 새롭게 뜨이는 것은 AR(항생제 내성균 등) bank를 수립하여 관련 제품 개발에 지원을 하고 Microbiome을 활용하는 방안들을 중요 기능의 하나로 제시하고 있으며 미국 CDC가 주관하여 OpenBiome 프로그램이 추진되고 있다. (참고: Randomized controlled trial of autologous microbiome reconstitution to prevent colonization by antibiotic resistant bacteria. Study in which stool will be collected from patients before they go to nursing homes. Then the stool will be re-administered to them after they receive antibiotics, to restore their microbiomes and prevent drug resistant infection.)
짐 오닐팀이 제시한 관련 대응 대체제 개발 분야(그림 8)에 의하면, 파아지를 이용한 치료제 개발, 항체 치료제, 면역증강제, 라이신형 효소제, 항균펩타이드를 개발할 것을 제시하고 있다. 최근 WHO에서 가장 critical한 내성균으로서 제시한 Clostridium difficile infection(CDI)에 대한 최근 논문에 의하면 이러한 방향들이 실제 CDI 항생제 내성균에 대해서 이들 제품 개발 방향이 다 적용되고 있는 것을 알 수 있다(14).
(그림 8) 짐 오닐 팀이 제시한 항생제 내성균 감염 제어를 위한 대체제 개발 전략

백신은 전통적으로 감염성 질병의 예방에 있어 비용대비 효과가 가장 우수한 제품으로 인정되고 있다. 항생제가 세균과 인체에 작용해서 변형균이 유도되게 하거나 인체의 기능을 변화시키게 한다면 백신의 경우는 원래 존재하는 인체의 면역능을 제고시켜서 감염성 균을 제어하는 것으로 내성현상이 전혀 생기지 않는다. 물론 백신에 저항성이 있는 균이 생기는 경우가 있으나 항생제의 경우와는 달리 극히 제한적인 범위에서 일어나는 현상이다. 이에 따라 지구상에서 이제 천연두에 이어 폴리오도 박멸이 눈앞에 가까이 와 있다. 동 분야는 본고에서는 깊게 논의하지 않겠다. 전반적인 감염성 질병에 관한 백신 개발 동향 및 기술개발 동향에 대해서는 저자의 그간 기고 자료를 참고해 주기 바란다(18~21).
따라서 본 고에서는 항생제 내성균에 대한 진단, 예방, 치료제 개발에 대해 고찰하고자 한다. 진단시약, 관련 기기, 백신, 항체, 마이크로바이옴, 파아지 영역에 이르기까지 전 세계적으로 광범위한 기술 영역에서 제품이 개발되고 있다.
□ 항생제 내성균의 진단제 개발 동향 및 유용성
항생제 내성균이 지속적으로 증가하고 있고 기존 항생제의 치료효율이 급감하는 상황에서 환자에 적절한 항생제가 처방되어 효율적인 치료 및 항생제 내성균의 저감화를 동시에 유도하기 위해서는 국내?외적으로 항생제 내성균의 모니터링 뿐만 아니라 일선 병원에서 항생제 처방시, 항생제 내성균의 보유 여부, 항생제 내성 특성의 스펙트럼의 신속한 확인이 치료효율을 높이는데 크게 기여할 것이다. 이를 위해 현재 다양한 항생제 내성균의 진단기술이 수립되어 있다. 가장 일반적으로는 항생제 감수성 검사로 미생물 배양 및 agar dilution 방법에 의한 특정 최소억제농도(MIC, minimum inhibition concentration)확인이 권장된다. 그러나 대부분 배양시간이 길고 비용이 많이 들며 적시에 환자에 필요한 항생제를 선정하는데는 시간이 너무 오래 걸리는 단점이 있다. 따라서 최근에 항생제 내성 균주에 특이적인 유전자 진단기술 및 진단기기가 개발되기 시작하였다. 관련 현황을 살펴보면 국내에서는 헬리코박터 파일로리의 항생제 내성 분석 분자진단 시약이 가장 앞서가는 시스템 중 하나이다. 국내에 허가된 제품은 현재 유일하게 헬리코박터 파일로리 항생제 내성균에 대한 (주)씨젠의 Seeplex®H. pylori-ClaR ACE Detection, Detection of two mutations causing clarithromycin-resistance 제품이 식약처에 등록되어 있다(그림 9). 국제적으로는 여러 종류의 항생제 내성균에 대한 여러 형태의 제품이 개발되어 있다. Hain Lifescience사의 헬리코박터 파일로리 진단시약, GenoType HelicoDR을 예시로 들었다. Clarithromycin과 Fluoroquinolone에 대해 동시에 내성을 평가할 수 있다(그림 10). 나아가서 real-time PCR법을 사용하여 3종류의 항생제 beta-lactams, fluoroquinolones, and macrolides 관련 내성을 검출하는 진단시약과 진단기기(medical device)도 개발이 되어 있다(그림 11).
(그림 9) DNA 칩과 자동분석기기를 사용하는 방법으로 clarithromycin 내성 관련 유전자 23S RNA의 변이 2종류 검출
http://www.seegene.com/neo/en/products/others/seeplex_HpyloriClar.php

(그림 10) DNA 칩과 자동분석기기를 사용하는 방법으로 Clarithromycin과 Fluoroquinolone에 대해
동시에 내성을 평가하며 관련된 유전자 15종류 이상을 동시에 확인하는 방법
HainLifescience;http://www.hain-lifescience.de/en/products/microbiology/helicobacter/genotype-helicodr.html
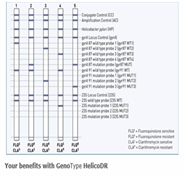
(그림 11) 항생제 내성균의 검출방법 중 real-time PCR법을 사용하는 시스템의 component
예: 3종류의 항생제, beta-lactams, fluoroquinolones, macrolides 관련 내성 유전인자 16종을 동시에 검출하는 방법

(http://www.clpmag.com/2016/10/addressing-antibiotic-resistance-molecular-diagnostics, October 5, 2016) High-throughput screening on the OpenArray TaqMan panel, the Applied Biosystems MagMax Express 96 magnetic particle processor for nucleic acid extraction and a high-throughput real-time platform, the QuantStudio 12K Flex Real-time PCR System from Thermo Fisher, Scientific can generate same-day results, and can be performed in conjunction with multiple identification technologies.
이들 진단시약 및 기기의 발전에 따라 1) 일선 병원에서는 감염환자의 항생제 처방 시, 감염된 미생물의 항생제 내성프로파일을 확인 후 맞춤형 항생제 처방(tailored therapy)으로 효율적 치료 및 무분별한 항생제 남용 억제로 항생제 내성균의 감소가 가능하도록 하였고, 2) 국가기관에서는 전국적인 항생제 내성률에 대한 레지스트리 구축을 위해 현재는 기술의 표준화가 어려운 agar dilution법을 이용하여 항생제 감수성 검사를 수행함으로써 전국적인 항생제 내성률 레지스트리를 구축을 진행하고 있다.
그러나 향후에는 체계적인 항생제 내성 분별 분자 진단 시약이 제공되어 효율적으로 모니터링을 실시할 수 있게 될 것이다. 전국적인 내성률 자료가 축적되면 이를 토대로 향후 경험적 항생제 제균 요법을 추천할 수 있는 기본 자료로 활용이 가능하며 제균 치료 효과의 극대화를 위해 내성 약제에 따른 맞춤형 제균 요법 (Tailored Therapy)에도 이용될 수 있을 것으로 기대된다.
□ 항생제 내성균의 항체 치료제 개발 동향 및 유용성
상기 언급한 바와 같이 항생제에 대해 지속적으로 내성균 발생이 예상되므로 더욱 근본적인 치료제는 항체치료제인 것으로 분석되며 동 시장의 점유율은 지속적으로 증가할 것으로 예측되고 있다. 다행히 precision medicine영역에서 항체제제의 개발이 활발하게 이뤄져 왔다(15, 19). 그 기술 영역이 확장되어 감염성 질병의 영역에 접목이 가능하며 각 국가가 효율적으로 대안을 마련할 필요가 있어 선진국, 대기업 중심의 대응을 시작하고 있다(그림 12와 참고문헌 20~22).
향후에 특정 항생제 내성균에 대해 맞춤형 항체 치료제를 생산할 수 있다면 그 치료 효능에 있어서 아주 유용할 것으로 기대된다.
(그림 12) 항생제 내성균에 대한 항체 치료제 개발 현황
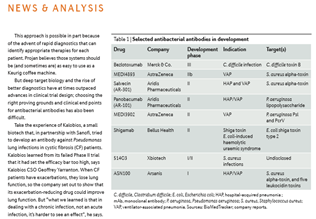
Merck사가 지난 해 말 미국 식약청으로부터 허가 받은 세계 최초 제품, Bezlotoxumab(Zinplava), Clostridium difficile infections(CDI)의 경우와 같이(23) 이들 항생제 내성균에 대한 항체치료제는 항생제 내성균 특이 치료제도 개발이 가능할 뿐만 아니라 toxinA와 B 항원에 대한 단클론항체 등으로도 제어가 가능한 것으로 보인다(그림 13). 다양한 감염성 세균 등에 대항 항체 치료제 중, 이 중에서 세계 최초로 Merck사 제품이 허가되어 항체치료제 개발의 새로운 파라다임 그리고 획기적인 진보로 평가되고 있다(Merck &Co.’s antibacterial antibody suggests that biologics could at last bring precision medicine to the anti-infective space).
(그림 13) Bezlotoxumab(Zinplava), Clostridium difficile infections(CDI)에 치료에 대해 미국 FDA, 2016년 10월 허가

그러나 아직 국내에서는 항생제 내성균에 대한 항체치료제 개발이 적극적으로 시도되고 있지 않고 있다. 이에 우리나라도 항생제 대체제 개발을 위한 항체개발의 필요성을 절실하게 느끼고 관련 기술을 수립하는데 참여해야 할 것으로 사료된다(참고: 2016년 9월 항체개발 기술 관련, 범부처신약개발사업단 초청 기고; 2017, 3월 식품과학회지 초청 리뷰, 아래 등).
본고에서는 깊게 다루지 않았으나 금번 살충제에 오염된 달걀과 산란계 등의 사태에서 보았듯이 항생제 내성균의 관리는 특히 축수산물의 항생제 사용과 인체에 사용하는 것, 그리고 관련된 균주 제조 등의 관리를 포함해서 체계적으로 종합적으로 관리되어야 한다.
5. 마무리글
항생제 내성균의 스크리닝 프로그램만으로 우리가 대처할 수 있을까? 모든 병원이 적절히 스크리닝 패널을 확보할 수 있을까? 누군가가 악의적으로 실험실에서 일상적으로 내성균 스크리닝 프로그램에서 거르지 못하는 특수한 내성균을 조작하여 퍼뜨린다면 이는 어느 누구도 대응할 수 없는 심각한 상황에 이르게 될 것이다. 이러한 경우에는 특정 균이 확인이 되는 순간, 이 균의 확산을 저지할 수 있는 긴급 처리 시스템이 발동하여 코디네이션이 되어야만 할 것이다. 즉 신속 진단, 관련 유전자 정보 확보 및 reverse genetic(역유전학)에 의한 대응치료제의 신속 생산 및 송부 등. 이러한 긴급 시스템이 작동하지 않는다면? 빌게이츠가 언급한 1년 내에 3천만 명의 사망은, 예측된 인류의 불행의 시작이고 인류 생존의 가장 커다란 위험임에 틀림없다.
특히 화학무기가 실전에 사용되는 것을 전 세계가 목도한 바. 실험실에서 미생물과 항생제 내성균, 항생제, 항균펩타이드 등의 개발을 진두지휘하는 연구자에, 악의적인 전문가가 관련된다면 이러한 다제내성의 위해균의 생산 및 악의적 이용의 가능성은 얼마든지 허구가 아님을 인지하고 있다. 따라서 실험실에서의 적법한 균주관리는 국가적, 인류적인 중요사임을 간과할 수 없게 된다. 최선의 대응전략은 항생제를 적절히 활용하되, 백신과 항체치료제 등을 보유해 두거나 신속 생산 및 사용할 수 있어야 할 것이다.
그러나 국내 상황을 보면 이러한 관리 체계에 큰 허점이 있음을 알 수 있다. 식품 축수산 관련 위해 미생물들이 인체에 쉽게 노출될 수 있고 더욱이 관리망을 피해 위해 균들이 국경을 넘어 이동하고 있어 더더욱 철저한 관리 체계가 이루어져야 할 것으로 보인다. 산업계나 학계의 연구실, 생산실에서 보관하는 균주목록과 실제 사용하는 균주들의 관계, 실험실 및 제조실 실사 등이 더욱 강화되어야만 한다. AI와 구제역에서 나아가, 인수공통감염균들이 증가하고 있는 상황에서 생산시설의 경우 어느 정도 국가기관의 관리를 받고 있으나 균주관리실태가 자발적 신고형태로만 관리되는 연구시설이나 소규모 제조시설들 경우, 언제 어디서, 누가 어떤 균주들을 이용하다가 의도적이든 비의도적이든 소위 monster microorganism이 생기지 않는다고 장담할 수 있을 것인가? 따라서 항생제 내성균 등의 관리체계도 더욱 강화되어야 할 것이다.
항생제 내성균에 대한 신규 항생제, 백신, 항체 치료제 뿐만 아니라 인트론바이오 등에서 개발 중인 파아지, 마이크로바이옴 등의 개발 및 활성화를 위해서는 국내 항생제 내성 균주 은행(http://knrrb.knrrc.or.kr/index.jsp?rrb=ccarm)의 활용도 필요한 것으로 보인다.
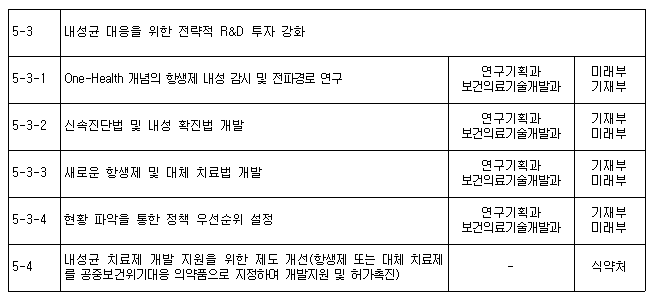
그러나 아직 항생제 내성균에 대해 필요한 대응 조처가 더 신속하게 진행되어야 할 것으로 생각된다. 특히 국가 항생제 내성 관리대책(2016~2020) 추진 과제 중 R&D 분야(표 7)에서 내성균 대응을 위한 전략적 R&D 투자 강화 분야 중 내성균 치료제 개발 지원을 위한 제도 개선(항생제 또는 대체 치료제를 공중보건위기대응 의약품으로 지정하여 개발지원 및 허가촉진)에 있어서도 미국의 경우에서 보았듯이 본고에서 논의한 항체치료제 등도 포함하여 신규 항생제 뿐만 아니라 항체치료제의 신속한 개발 및 허가로 이어질 수 있도록 위기대응 및 산업 발전의 두 마리 토끼를 잡을 수 있는 선제적 제도가 마련되기를 기대해 본다.
(표 7) 국가 항생제 내성 관리대책(2016~2020) 추진 과제
우리는 새로운 전략 기술 탐색의 필요성이 크다. 4차 산업혁명은 빅데이터를 활용하여 인류보건 증진에 크게 이바지하는 시스템이 만들어질 것으로 예측하고 있는 바 항생제 내성균 surveillance 시스템과 관련 빅데이터 확보 및 지속적인 스크리닝를 통해서 유전자 조작으로 무기화 가능한 부분을 원천 차단할 수 있어야 할 것이다. 동시에 이러한 시스템을 활용하여 진단제 및 항체 치료제 등을 신속 생산 및 전략적 개발 체계를 통해서 활용할 수 있는 POCT &치료제 개발 전략으로 연결할 필요가 있다. Health threat를 대응하기 위해 Open innovation에 의한 협력 연구사업 전략, 연계 시스템 관리 체계 수립으로 즉 생산의 smart화, 규제의 긴급상황 대응성 등을 연계하여 돌파구 마련이 가능할 것으로 기대된다.
6. 참고문헌
1. http://www.who.int/antimicrobial-resistance/en/.
2. https://en.wikipedia.org/wiki/Antimicrobial_resistance.
3. Notes from the Field: Pan-Resistant New Delhi Metallo-Beta-Lactamase-Producing Klebsiella pneumoniae — Washoe County, Nevada, 2016; Weekly / January 13, 2017 / 66(1);33; https://www.cdc.gov/mmwr/volumes/66/wr/mm6601a7.htm.
4. The Challenge of Antibiotic Resistance, Stuart B. Levy, 1994, 46-53 March 1998, Scientific American.
5. Tackling Drug-resistant infections globally: Final report and recommendations, The review on antimicrobial resistance chaired by Jim O’Neill, May, 2016.
6. https://rusi.org/event/GatesatRUSI.
7. Bill Gates warns a bioterrorist attack could be deadlier than a nuclear bomb, Credit:David Rose, Science editor, Apr. 19, 2017.
8. 동 번역문은 ''바이오테러' 증가할 것'…빌 게이츠 '경고' 2017-04-20 16:54CBS 노컷뉴스 임형섭, http://www.nocutnews.co.kr/news/4771791#csidxbe0ae567050e9efa64ecef6866c3957 에서 인용한 것임.
9. WHO 보고(2014) Antimicrobial resistance: global report on surveillance 2014.
10. 여러 보도자료들.4건, 2016년 12월 30일, 질병관리본부 보도자료 (http://news.jtbc.joins.com/article/article.aspx?news_id=NB11449973).
11. https://www.cdc.gov/drugresistance/solutions-initiative/index.html.
12. http://www.who.int/antimicrobial-resistance/global-action-plan/en/.
13. ‘빅파마가 다시 뛰어드는 항생제 시장’, 노경철, 2016.
14. 2017, Feb. 27, WHO report, (http://www.who.int/mediacentre/news/releases/2017/bacteria-antibiotics-needed/en/).
15. Therapy for Clostridium difficile infection – any news beyond Metronidazole and VancomycinPublisher: Taylor &Francis, Expert Review of Clinical Pharmacology 03 August 2017.
16. Recent FDA Antibiotic Approvals: Good News and Bad News , 12 Mar 2015 Author: Ursula. Theuretzbacher,http://cddep.org/blog/posts/recent_fda_antibiotic_approvals_good_news_and_bad_news#sthash.uVHOmWym.dpbs(http://www.cddep.org/tool/fda_new_molecular_entity_antibiotic_approvals_1981_2015#sthash.kjN39x6v.dpbs).
17. '슈퍼박테리아' 이기는 新항생제‥한국서는 그림의 떡?, 박으뜸, acepark@medipana.com 2017-08-14.
18. VLP, 성공적 바이오의약품 생산 플랫폼 전략적 구축, 범부 처신약개발사업단, 박순희. 2013,
19. 백신 개발과 BT-CT 융합, 접합백신(Conjugate vaccine)의 개발, J. PhamTech., 박순희, 2014.
20. 바이오마커 기반 암면역치료제 개발 국제 동향과 개발 전략, 범부처신약개발사업단, 박순희, 2016http://kddf.org/bbs/bbs.asp?no=98&mode=view&IDX=1432&p=1&cateId=39, http://www.dailypharm.com/News/217087.
21. 난황에 축적된 IgY(Immunoglobulin Y) 생산 기술의 응용 - 축·수산물의 질병제어 및 헬리코박터 등 인체질환 적용기술 개발 동향, 식품과학회지, 박순희, 2017.
22. News and Analysis: Antibacterial antibodies gain traction First pivotal study win for Merck &Co.’s antibacterial antibody suggests that biologics could at last bring precision medicine to the anti-infective space, Nature Reviews, V14, Nov.(737 ~8), 2015.
23. Bezlotoxumab for Prevention of Recurrent Clostridium difficile Infection, N Engl J Med 2017; 376:305-317 January 26, 2017DOI: 10.1056/NEJBezlotoxumab gained FDA approval in October 2016: 'indicated to reduce the recurrence of Clostridium difficile infection (CDI) in patients 18 years of age or older who are receiving antibiotics for CDI and are at high risk for recurrence.“Moa1602615;.
이전
2017.05.31
다음