항암바이러스(Oncolytic virus) 치료제의 개발 전략
김용철 (재)범부처신약개발사업단 사업개발팀 선임연구원
2015년 10월 미국식품의약국(Food and Drug Administration, FDA)로부터 흑색종(Melanoma) 치료제로 승인을 받은 미국 암젠(Amgen)의 임리직(lmlygic, talimogene laherparepvec)을 시작으로 최근 종양면역요법(Cancer immunotherapy)으로 주목 받고 있는 항암바이러스(Oncolytic virus)란 복제가 가능하고 감염력이 있는 바이러스로서 야생형(Wild-type) 혹은 약독화된 바이러스에 종양세포 내 유전적으로 비정상 부위를 타겟(Target)으로 하는 특정유전자를 삽입하여 암 치료에 사용하는 바이러스이다. 이러한 유전자 조작된 항암바이러스(Oncolytic virus)는 바이러스의 복제 후 세포 용해와 함께 조직을 통한 바이러스의 확산은 암세포와 암세포 주변 혈관 내에서 선택적으로 일어난다.
항암바이러스로 이용 가능한 바이러스의 일반적인 종류와 특징
다양한 종류의 바이러스가 항암바이러스로써의 가능성을 두고 연구가 진행되고 있다. 바이러스의 종류로는 이중가닥바이러스(Double-stranded virus)에 속하는 Herpes simplex virus type 1(HSV-1), Adenovirus, Vaccinia virus, Reovirus 가 있고, 음성 단일가닥바이러스(Negative ss RNA virus)에 속하는 Newcastle disease virus가 있다. 이와 함께 연구자들은 자신들의 대상 질환 및 세균의 특성들에 따라 바이러스를 선택해서 연구를 진행하고 있다. 그 특징들로는 접종 가능한 바이러스의 최대 농도(Achievable titer), 생활사(Life cycle), 항바이러스제의 사용 가능 여부(Specific antiviral agent), 유전자 조작의 용이성(Ease of genetic manipulation), 투여 시 인체에서 발생하는 면역원성(Immunogenicity), 야생형 바이러스의 병독성(Virulence of wild type virus)이 있으며 일반적인 각 바이러스의 특징이 있으며(테이블 1) 이와 함께 바이러스는 후보자들은 종양 선택성(Tumor selectivity)과 인체의 면역 기능에(Immune function) 각기 다른 특징들을 가지고 있다. (테이블 2)
(테이블 1) General biology, advantages, and disadvantages of various viral vectors for cancer gene therapy
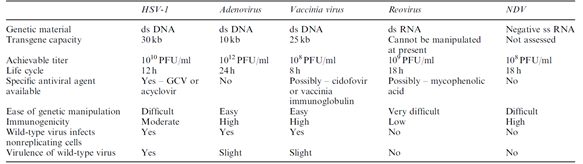
출처: Manish Aghi et al, Oncogene (2005) 24, 7802–7816
(테이블 2) 항암 바이러스(Oncolytic virus)의 종양 선택성(Tumor selectivity)와 면역 기능(Immune function)
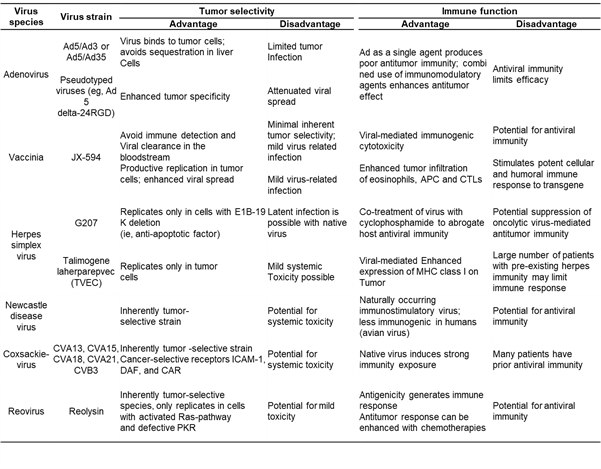
약어: Ad, adenovirus; APC, antigen presenting cell; CTL, cytotoxic T lymphocyte; CVA/CVB, coxsackie virus A or B; DAF, decay-accelerating factor; ICAM, intercellular adhesion molecule;; MHC, major histocompatibility complex; PKR, protein kinase receptor; (출처: Lawler SE et al, Cancer Sci. 2016 Oct; 107(10): 1373–1379.)
항암바이러스(Oncolytic virus)의 기술 및 작용 기전(Mechanisms of OV Action)
항암바이러스(Oncolytic virus)의 작용 작용 기전을 살펴 보면 많은 개발사들의 전략을 이해할 수 있으며 그 작용기전은 다음과 같다 (그림 1).
1. 직접적인 암세포 용해(Cancer cell lysis): 항암바이러스(Oncolytic virus)의 유전자의 변형을 통해 암세포 특이적으로 감염 및 공격할 수 있도록 만들어진 항암바이러스이다. 예를 들어, 암세포에서 주로 발현하는 효소(예, Tyrosine kinase, 신라젠’펙사벡’)를 이용하여 자신을 복제할 수 있는 바이러스를 제작하여 사용을 한다. 이러한 용해된 암세포의 물질들은 항원제시세포(Antigen-presenting cell)에 의해 포획되어 종양특이적 T 세포 반응(Tumor-specific T cell) 촉발시킨다.
2. 면역증진 기능(Immunogenicity function): 항암바이러스는 다양한 방법으로 인체의 면역증진 기능을 한다. 감염된 항암바이러스(Oncolytic virus)자체가 인체의 면역 기능을 증진 시키는 역할을 한다. 이와 더불어 항암바이러스(Oncolytic virus)의 벡터에 싸이토카인(Cytokine) 및 케모카인(Chemokine)과 같은 면역조절(Immunomodulatory gene)을 삽입하여 인체의 면역 기능을 조절하기도 한다. 많이 사용되는 유전자 들은 IL-2. IL-12, IL-18, IFN-α/β, TNF-α, 과립구 대식세포 콜로니 자극인자(Granulocyte-macrophage colony-stimulating factor, GM-CSF)등과 같은 유전자를 벡터에 이식하게 되며 이러한 물질들은 세포독성 면역 세포(Cytotoxic immune effector cells)들이 효과적으로 작동하여 암세포를 제거 하는데 도움을 준다.
3. 종양 특이적 억제 유전자 삽입(Tumor-suppressor gene insertion): 최근에는 종양 세포의 용해는 물론 암세포 신생혈관(Cancer angiogenesis)과 관련된 유전자 및 물질을 억제할 수 있는 Vascular endothelial growth factor (VEGF), Endostatin, angiostatin, Vaculostatin, Fibroblast growth factor receptor 등을 타겟(Target)으로 하는 inhibitor 혹은 miRNA등을 첨부하여 항종양효과를 높이기 위한 노력들이 진행되고 있다.
(그림 1) 항암바이러스(Oncolytic virus)의 작용 기전
출처: Guo ZS et al, Front Immunol. 2017 May 15;8:555.
항암바이러스(Oncolytic virus)의 개발 시 고려 사항
많은 수의 항암바이러스 단독 혹은 다른 약물과의 조합을 통한 임상연구가 진행되고 있다. 하지만 아직까지 임상시험 시 고려되어야 할 사항들이 있으며 안전성(Safety), 종양 부위까지의 전달 방법(Delivery), 바이랄 약물동력학(Viral pharmacokinetics), 바이랄 약물학적효과(Viral pharmacodyamic), 효과 확인을 위한 바이오마커(Biomarkers) 개발, 적절한 동물 모델의 개발 등의 넘어야 할 장애물이 존재한다.
1. 안전성(Safety) 유독성(Toxic), 부작용(Adverse effects)
아직까지 항암바이러스(Oncolytic virus)들의 임상시험에서 심각한 문제점은 보고되지는 않았지만 개발 단계에서 바이러스의 특성에 의한 부작용을 고려할 필요가 있다. 비록 항암바이러스(oncolytic virus)들이 종양세포만을 타겟하게 조작 되었지만 정상세포에 영향을 미칠 수 있는 Off-target effects을 통한 의도치 않은 독소 효과를 나타낼 가능성도 있다. 이와 더불어 바이러스의 특징인 유전자의 돌연변이(Mutation), 진화(Evolution), 재조합(Recombination) 등이 발생하여 원하지 않는 결과가 나타날 수 있다. 그리고 인체의 면역 시스템이 손상 및 약화(Immunocompromised) 환자의 경우 바이러스 치료가 적합한지에 대한 연구가 필요하다. 일반적으로 종양조직 내로의 로칼 딜리버리(Local delivery)의 경우 부작용이 적다고 알려져 있다. 대표적인 부작용으로는 약한 인플루엔자유사(Mild flulike)증상이 나타날 수 있지만 전신 적용(Systemic administration)의 경우에는 부작용이 심해질 수 있음을 고려해야 한다.
2. 용량
종양의 종류, 환자의 상태에 따라 항암바이러스(Oncolytic virus)와 병용요법으로 사용될 약물에 따른 최대허용용량(Maximum tolerated dose)가 선행 연구되어 정립되어야 할 필요가 있다. 과도한 바이러스의 주입 및 인체 내 복제는 바이러스에 의한 사이토카인 폭풍(Ctokine storm)으로 다량의 사이토카인 분비에 의해 바이러스성 출혈열이 발생할 수도 있다.
3. 항암바이러스의 종양 내에서의 복제, Immune infiltrates, 항암 바이러스로 인한 순환성 면역세포(Circulating immune cell) 상태 등을 파악할 할 수 있는 바이러스의 약물동력학(Viral pharmacokinetics) 및 약물학적효과(Viral pharmacodynamics), 효과 확인을 위한 바이오마커(biomarkers)의 추가적인 개발이 필요하다.
4. 바이러스 투여 방법의 고려(Intratumoral or intravenous injection)
현재까지 바이러스에 대한 인체의 면역 시스템으로 인해 약물의 효과 감소 및 부작용을 우려해 많은 항암바이러스 투여 방법으로 종양내 주사(Intratumoral injection)으로 연구되었다. 우리의 인체는 바이러스의 정맥내 주사(Intravenous injection)를 통한 전달에 대한 방어 시스템을 가지고 있다. 그것들은 혈액 내에 존재하는 기존항체(Preexisting antibody), 보체 활성화(Complement activation), 간(Liver) 혹은 비장(Spleen) 과 같은 조직(Tissue)에 의한 비특이적 섭취(Nonspecific uptake)등으로 인해 바이러스의 효과가 줄어들 가능성이 있다. 하지만 정맥내 주사를 이용한 치료법은 종양내 주사와 비교하여 비교적 주사 방법이 쉬워 많은 연구자들의 이용성이 좋고 전신에 암이 퍼져나간 환자 치료의 가능성이 있기 때문에 인체의 면역 기전을 회피하고 부작용 없이 암세포만을 죽일 수 있는 여러 방법들이 연구되고 있다.
5. 효능 평가를 위한 적절한 동물 모델의 개발 및 대안연구 개발
항암바이러스를 활용한 많은 인체실험의 실패의 원인이 기대했던 효능을 확인하지 못 한 결과이다. 우리는 현재 발암물질(Carcinogen-induced) 유도를 통한 암 유발 동물모델, 유전자 변이를(Genetically engineered) 통한 암 유발 모델, 암 환자의 암세포를 이용한 암환자 유래 동물모델(PDX: Patient-Derived Xenograft)등을 이용하여 임상시험 전에 비임상 실험을 통하여 항암치료제의 효능을 확인하고 있다. 생쥐의 암은 치료 했지만 사람의 암은 치료하지 못하는 실정이다. 물론, 동물실험을 거치지 않고 신약이 개발 된다는 것은 불가능하다. 따라서 우리는 암 환자와 비슷한 환경을 만들어 줄 수 있는 동물 모델을 개발하는데 힘을 쏟아야 할 것이다. 이와 함께 종양 환자의 수술 후 버려지는 인간 세포조직을 활용한 연구 및 사망한 암 환자의 ‘부검’을 통한 연구도 고려해 볼 필요성이 있다.
최근 항암바이러스의 개발 전략
최근에는 앞서 기술된 부작용을 줄이고 인체의 면역 반응을 회피하여 종양세포를 좀 더 잘 없애기 위한 항바이러스 기술 개발에 많은 연구자들이 힘쓰고 있다. 그 전략들로는 인체의 중화항체(Neutralization antibody)에 맞서기 위해 항암바이러스를 나노파티클(nanoparticle), 화학적 캡시드(chemical capsid)등을 통하여 바이러스를 항체로부터 보호하는 기술들이 개발되고 있다. 또한 바이러스의 유전자 조작을 통하여 종양세포에서만 특이적으로 발현하는 세포막 단백질 등을 인식될 수 있는 물질을 캡시드(capsid)에서 발현하게 하여 암세포에 대한 친화성을 높이고 있다. 이와 함께 정상세포에서는 바이러스의 mRNA가 파괴될 수 있는 microRNA를 삽입하여 정상세포에서 바이러스가 증식되는 것을 방지한다. 또한 바이러스의 벡터에IL-2. IL-12, IL-18, IFN-α/β, TNF-α, 과립구 대식세포 콜로니 자극인자(Granulocyte-macrophage colony-stimulating factor, GM-CSF)등과 같은 유전자를 삽입하여 인체의 면역 기능을 높이는 작용을 기대하기도 한다. 최근에는 항암바이러스의 단독 처리가 아닌 병용요법(combination therapy)를 이용하여 종양의 치료 효과를 높이고 있는데 대표적으로 약물을 통한 항암화학요법(Chemotherapy), 방사선요법(Radiotherapy), 수지상세포 백신(Dendritic cell based vaccine), PD-1 혹은 PD-L1과 같은 면역관문억제제(Immune checkpoint inhibitor)등이 병용요법으로 사용되는 치료 방법이다. 흥미롭게도 Parvovirus와 Reovirus를 병용 처리하는 연구도 진행되고 있다. (테이블 3)
(테이블 3). Recent preclinical virotherapy research activities in German academia (과학적 개발 전략)
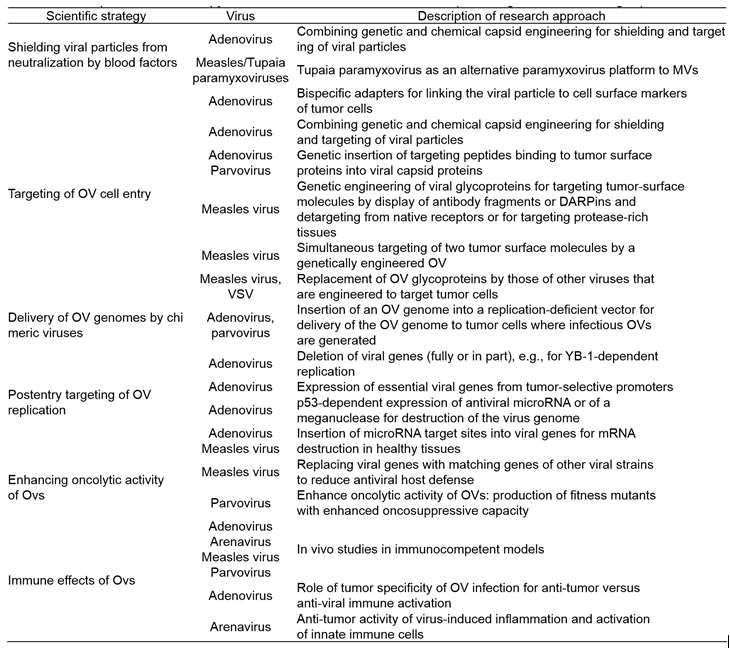
(테이블 3 계속)
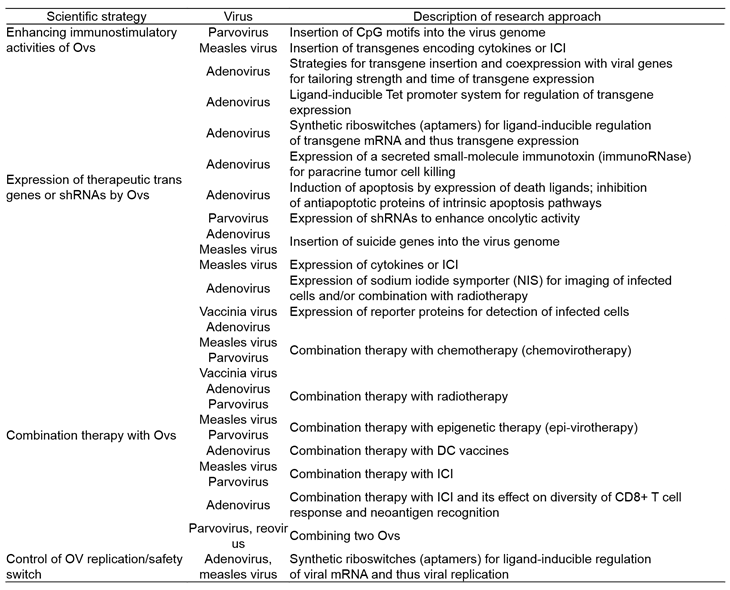
약어: DARPin, designed ankyrin repeat protein; ICI, immune checkpoint inhibitor; MV, measles virus; OV, oncolytic virus; shRNA, short hairpin RNA; VSV, vesicular stomatitis virus.
출처: Ungerechts G, et al. Hum Gene Ther. 2017.
항암바이러스(Oncolytic virus)의 임상시험 적용사례
다양한 종류의 바이러스가 항암치료제로써의 가능성으로 임상 연구가 진행 되었다. 그 중 Herpesvirus, Adenovirus, Vaccinia Virus, Measles Virus, Coxsackievirus, Polio Virus, Retrovirus, Reovirus, Parvovirus H1, Vesicular Stomatitis Virus, Newcastle Disease Virus가 보고되었으며 바이러스 유전자 부위의 조작(modification), 삽입(insertion), 결손된(deletion) 부위의 특징과 보고된 임상시험 결과는 다음과 같다<테이블4>.
<테이블 4> 연구 결과가 보고된 항암바이러스의 특징 및 임상시험 결과
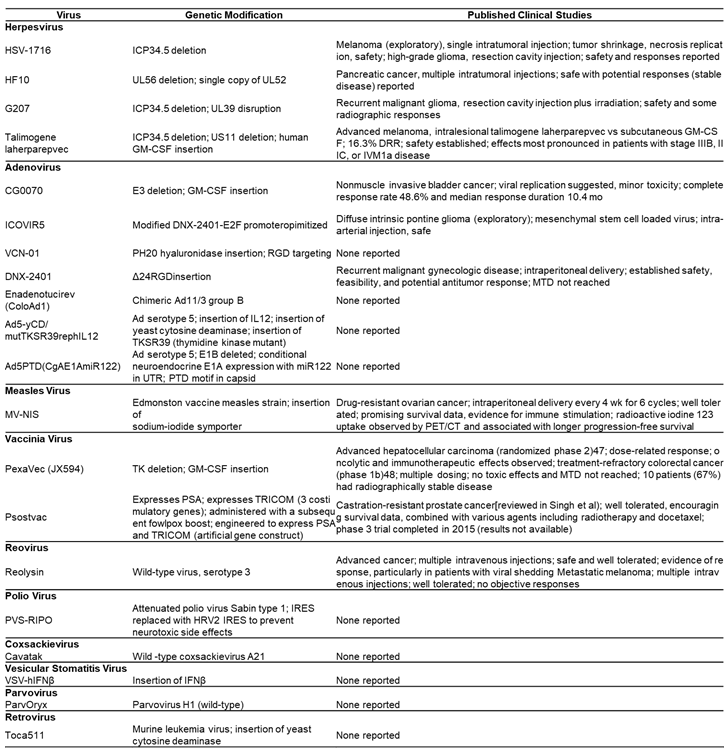
약어: CT, computed tomography; DRR, durable response rate; GM-CSF, granulocyte-macrophage colony-stimulating factor; HSV, herpes simplex virus; IFNβ, interferon β; IRES, internal ribosome entry site; MTD, maximum tolerated dose; PET, positron emission tomography; PSA, prostate-specific antigen; PTD, protein transduction domain; RGD, arginine-glycine-aspartate; UTR, untranslated region; VSV, vesicular stomatitis virus.
(출처: Lawler SE et al, Cancer Sci. 2016 Oct; 107(10): 1373–1379.)
국내 연구 현황
국내 연구진 역시 항암바이러스(Oncolytic virus)을 이용하여 항암효과에 대한 연구를 활발히 진행 중에 있다. 한양대학교 윤채옥 교수 연구팀에서는 정상세포에는 손상을 입히지 않으면서 암세포만 선택적으로 공격하여 살상하는 종양 특이적 살상 아데노바이러스(Oncolytic Adenovirus)를 개발하여 연구 중이다. 연구팀에 따르면 암세포에서만 선택적으로 활성이 되는 프로모터(Promoter)를 삽입하고 세포 감염에 중요한 역할을 하는 바이러스 파이버(fiber) 부위를 변형(modification)하여, 암세포 특이성이 보다 향상되고 정상세포에 대한 부작용을 현저히 감소시킨 아데노바이러스를 개발하여 연구를 진행 중에 있다고 한다. 또한, 바이오벤처 신라젠은 우두바이러스(Vaccinia)기반 항암제 ‘펙사벡’(Pexa-Vec)을 면역항암제인 BMS의 ‘옵디보(Opdivo)’와 함께 병용 투여해 감안 치료 효과를 확인하는 임상 시험이 유럽에서 시작되었다. 신라젠의 펙사벡(Pexa-Vec)은 암세포가 분비하는 과발현 티미딘인산화요소(thymidine kinase)를 이용하여 정상세포가 아닌 암세포만 감염시키도록 유전자 조작된 우두(vaccinia)바이러스를 기반으로 하는 항암신약 후보 물질이다. 또한, 암세포만을 선택적으로 공격하여 암세포 파괴 과정에서 인체의 체내면역반응 촉진으로 지속적인 암세포를 공격하는 것과 동시에 암세포와 연결된 혈관세포 폐쇄를 통한 암세포 성장 억제하는 작용기전으로 알려져 있다.
결론
현재 종양면역요법(Cancer immunotherapy) 개발을 위해 전 세계적으로 많은 연구들이 진행되고 있다. 바이러스의 유전자 및 캡시드(Capsid)의 조작을 통하여 인체의 면역 반응을 회피하고 인체 종양 세포만을 인식하여 증진된 항암효과로 종양을 적절히 제거 하며 인체의 면역 기능을 증진 시키 등의 개발 전략과 함께 임상 시험에서 병행요법(Combination therapy)의 후보 물질인 면역관문억제제(Immune checkpoint inhibitor)로부터 이중 특이적 T세포 관여항체(Bi-specific T-cell Engager, Bite), CAR-T(Chemeric antigen receptor T-cell or NK cells), 항바이러스(Oncolytic Virus) 등의 다양한 플랫폼을 활용하여 암 정복을 위한 수많은 연구들이 진행되고 있다. 항암바이러스(Oncolytic virus)를 연구하는 전문가들이 주장하는 가장 큰 매력은 바로 기존 치료제와는 다르게 바이러스는 살아있다는 것이다. 이와 함께, 바이러스는 그 자체로의 유전자를 소유하기 때문에 스스로 번식할 수 있어 주사된 부위 외에 인근에 있는 암세포에까지 감염을 일으켜 파괴할 수 있다는 점이다. 물론, 임상에서 항암바이러스가 상용화되기 위해서는 앞서 기술된 장애물을 넘어야 하는 어려움이 있겠지만, 궁극적으로 암 환자에 있어 단순한 생명연장이 아닌 완치의 목적을 위해 항바이러스(Oncolytic virus) 기술로 발전시킬 필요성이 있다.
Selected References
1. Lawler SE, Speranza MC, Cho CF and Chiocca EA. Oncolytic Viruses in Cancer Treatment: A Review. JAMA Oncol. 2017 Jun 1;3(6):841-849.
2. Anna C. Filley and Mahua Dey, Immune System, Friend or Foe of Oncolytic Virotherapy?. Front Oncol. 2017; 7: 106.
3. Boozari B, Mundt B, Woller N, Struver N, Gurlevik E, Schache P, et al. Antitumoural immunity by virus-mediated immunogenic apoptosis inhibits metastatic growth of hepatocellular carcinoma. Gut 2010; 59(10):1416–26.
4. Miyamoto S, Inoue H, Nakamura T, Yamada M, Sakamoto C, Urata Y, et al. Coxsackievirus B3 is an oncolytic virus with immunostimulatory properties that is active against lung adenocarcinoma. Cancer Res 2012; 72(10):2609–21.
5. Bartlett DL, Liu Z, Sathaiah M, Ravindranathan R, Guo Z, He Y, et al. Oncolytic viruses as therapeutic cancer vaccines. Mol Cancer 2013; 12:103.
6. Guo ZS, Liu Z, Bartlett DL. Oncolytic immunotherapy: dying the right way is a key to eliciting potent antitumor immunity. Front Oncol 2014; 4:74.
7. Prestwich RJ, Errington F, Diaz RM, Pandha HS, Harrington KJ, Melcher AA, et al. The case of oncolytic viruses versus the immune system: waiting on the judgment of Solomon. Hum Gene Ther 2009; 20(10):1119–32.
8. Pol J, Vacchelli E, Aranda F, Castoldi F, Eggermont A, Cremer I, et al. Trial Watch: immunogenic cell death inducers for anticancer chemotherapy. Oncoimmunology 2015; 4:4.
9. Ungerechts G, Engeland CE, Buchholz CJ, et al. Virotherapy Research in Germany: From Engineering to Translation. Hum Gene Ther. 2017; Oct;28(10):800-819.
10. Guo ZS, Liu Z, Kowalsky S, et al. Oncolytic Immunotherapy: Conceptual Evolution, Current Strategies, and Future Perspectives. Front Immunol. 2017; May 15;8:555.
이전
다음
2017.11.28