'누출된 혈액은 뇌를 해롭게 한다'
범부처신약개발사업단 사업개발팀 신상훈 책임연구원
(본 기고는 Nature Reviews of Neuroscience, 2018년 5월호에 게재된 “Fibrinogen in neurological diseases : mechanisms, imaging and therapeutics”의 내용을 바탕으로 작성하였다.)
|
요약
뇌는 신경세포와 혈관으로 구성되어 있는데 혈관은 신경세포에 영양분을 공급하고 혈뇌장벽(Blood Brain Barrier, BBB)을 형성한다. 혈관에 구멍이 나서 이 혈뇌장벽이 파괴되면 혈액 누출이 발생하는데 이 누출은 신경세포사를 일으킨다. 뇌에서의 혈액누출은 (1)염증을 일으켜 병원성을 나타내고, (2)신경세포사는 독성을 일으키며, (3) 손상의 복구에는 면역세포들이 관여한다. 광범위한 신경계 질환과 혈뇌장벽의 파괴를 수반하는 외상손상에서 혈액응고 단백질인 피브리노겐(fibrinogen)은 뇌에 축적된다. 최근의 연구에 따르면 CNS (Central Nervous System) 염증의 활성화, 뇌에서의 흉터 형성 유도, 인식 저하 촉진 및 복구 억제에 있어서 피브리노겐의 다양한 역할이 밝혀졌다. 이러한 다양한 역할은 피브리노겐의 독특한 구조 때문이며, 이 구조에는 세포 수용체 및 신경계에서 발현되는 단백질에 대한 다중 결합부위가 포함된다. 피브리노겐의 작용을 구성하는 세포 및 분자 기전이 밝혀지면서 다발성경화증(Multiple Sclerosis, MS), 알츠하이머 병(Alzheimer’s Disease, AD) 및 외상성 중추 신경계 손상(Traumatic Brain Injury, TBI)과 같은 신경계 질환에 피브리노겐이 관련되어 있다는 것을 알게 되었다. 피브리노겐이 갖고 있는 유익한 효과인 지혈작용에는 영향을 미치지 않으면서 신경계에서의 손상적인 기능인 면역활성화 작용만을 억제할 수 있는 선택적 약물 표적화가 가능해진다면, 신경계 질환에서 피브리노겐을 타겟팅 하는 신규 파이프 라인을 열 수 있게 될 것이다. 또한, 실시간 이미징이 가능하여 누출을 감지할 수 있다. 그 원인이 되는 피브리노겐의 활성을 저해하는 단클론항체를 MS, AD의 동물모델에서 뇌에 투여하면 활성억제 효과를 보여 준다. (ref 1) |
새로운 동물모델과 특정한 바이오 마커, 그리고 치료제 개발연구에 의하여 혈관생물학, 면역학, 신경과학의 접점에서 연구되어 오던 신경계 질환의 원인들이 밝혀지고 있다. 중풍 (Stroke)과 MS에서 주로 연구되어 오던 뇌혈관생물학과 신경면역학 분야의 연구결과가 다른 신경계 질환으로 확장되고 있다. 혈관과 CNS의 접점인 BBB의 누출로 인한 혈장 단백질의 유입은 가장 근본적인 변화이다. 그렇다면, 과연 BBB 누출과 면역활성화, 그리고 신경퇴행의 분자적인 연결점은 무엇인가? 이에 대한 한가지 단서로 피브리노겐이 미세교세포(microglia)와 대식세포(macrophage)에 있는 CD11b/CD18 인테그린 수용체에 결합하여 신경염증성 질병에서 나타나는 신경성적인 결함에 기여한다는 연구결과가 나온 바 있다. 이런 결과는 신경세포, 교세포(glia), 혈관, 면역세포들 사이에서 피브리노겐이 중요한 분자적 연결 접점임을 시사한다. (ref 2)
피브리노겐은 간에서 분비되는 340 KDa의 당단백질이며 수용성의 Homodimer로 혈액내에서 순환되는데, Monomer 각각은 3개의 폴리펩타이드(polypeptide)로 구성되어 있다. 혈액응고 연쇄작용이 활성화 될 경우 피브리노겐은 불용성의 피브린(fibrin)으로 전환된다. 트롬빈(thrombin)은 피브리노겐을 잘라서 폴리머 형성 부위를 노출시켜서 혈전생성을 촉진한다. 형성된 피브린 혈전은 tPA(tissue type Plasminogen Activator)등에 의해 활성화된 플라스민(plasmin)에 의해 분해된다.
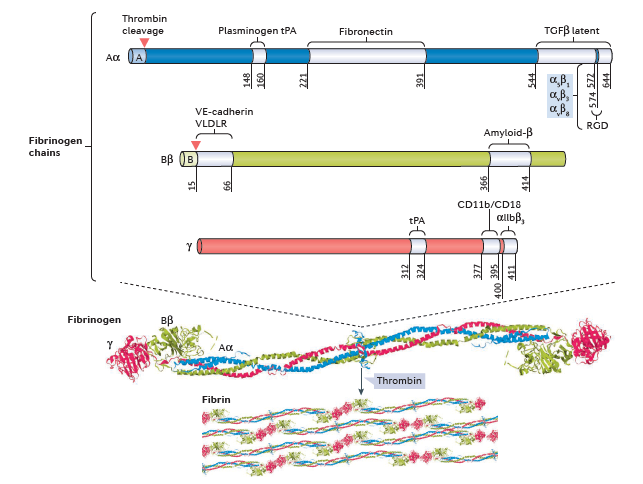
Figure 1 피브리노겐 구조, 세포내 타겟 (from ref 1)
피브리노겐에서 피브린으로의 다형체(polymer) 형성은 피브리노겐 카복시 말단 (carboxy-terminus)에 있는 단백질 계통학적으로 매우 잘 보존된 부위인 FReDs(fibrinogen-related domains)에 의하여 이루어 진다. FReD를 갖는 단백질들은 선천성면역 (innate immunity)이나 염증반응에 관여하는데, 척추동물의 피브리노겐만이 혈액응고에 관여하는 것으로 볼 때, 진화론적 관점에서 피브리노겐의 혈액응고 기능은 독특하고 최근에 부여된 형질로 보인다.
이 외 에도 피브리노겐은 혈관주위 세포외기질 (pericyte extracellular matrix)의 구성요소로 직접 신경혈관계의 구성요소들과 상호작용을 통해 면역, 신경퇴행, 손상된 CNS의 복구에 관여한다.
대부분의 신경계 질병에 있어서 생리적인 CNS 기능에 필수적인 (1)보호역할을 하는 평형상태에서부터, 유입된 혈장단백질과 면역세포들이 신경계의 퇴행적인 과정을 주도하게 되는 (2)염증적인 평형상태로의 극적인 변화가 있다. 한가지 예시로, 아래 Figure 2에서 보여주는 바와 같이, 건강한 CNS 에서는 미세교세포가 균등하게 분포되어 있는 반면, EAE 모델에서는 질병발생 전에는 피브리노겐이 CNS로 누출되어 미세교세포의 확장을 유도하여 혈관구조 쪽으로 세포몸체가 축적되도록 한다. 질병이 최고조에 있을 경우에는 미세교세포의 혈관구조 쪽으로의 클러스터링과 피브린이 축적된 부위에만 거의 전적으로 일어난다. 그리하여 미세교세포로부터 ROS가 분비되고 축삭 손상이 일어난다. 이 과정에서 분자적인 연결점으로 CD11b/CD18 인테그린 수용체를 통한 피브리노겐 신호전달이 혈관주위의 클러스터 (cluster)형성과 축삭 손상(axonal damage)에 있어 필수적임을 보여준 결과가 있다. (ref 2)
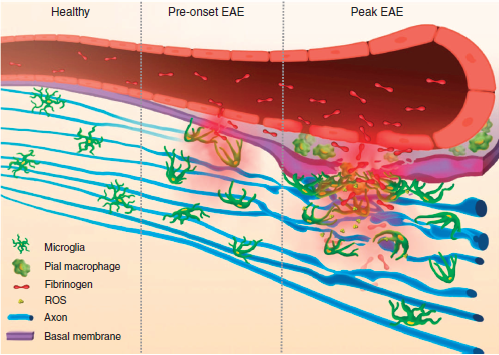
Figure 2. BBB 파괴에 따른 혈관주위의 미세교세포(microglia)와 대식세포(macrophage)의
클러스터링(clustering)과 신경면역질병에서의 축삭 손상에 미치는 영향에 대한 모식도 (from ref 2)
피브리노겐 g377-395 펩타이드를 생쥐에 비강투여 하거나 백신으로 사용하면 EAE(Experimental Autoimmune Encephalomyelitis)에서 보호되는 결과를 얻었다. 이를 통해 CNS로의 피브리노겐 유입과 CD11b를 매개로 한 미세교세포의 활성화는 염증성 탈수초화(demyelination)를 이끌어내는 중요하고 상위에 있는 분자적인 이벤트(molecular event)임을 보여준다. 중요한 점은 이런 피브린-CD11b/CD18 상호작용의 저해는 피브린의 혈액응고 작용에는 영향을 주지 않는다. 따라서 g377-395를 타겟 하는 펩타이드나 항체는 CNS 병리를 타겟하는 치료제가 될 수 있다.
피브린-CD11b/CD18의 결합을 유전학적 그리고 약리학적으로 저해하면 EAE에서 나타나는 마비, 염증, 미세신경교세포(microglia) 활성화, 축삭 손상(axonal damage), 탈수초화(demyelination)등이 감소한다. 이런 MS분야에서의 결과를 AD 분야에서 찾아 보면, AD transgenic과 피브리노겐 유전자인 Fga+/- 동물모델을 통하여 피브리노겐의 결핍이 미세교세포 활성 저하와 인지결핍을 보호하는 결과가 제시된 바 있다. (ref 3, ref 4) AD 실험동물에서 피브린과 아밀로이드b의 상호작용을 특이적으로 저해하는 화합물인 RU-505를 투여하면 혈관병리를 감소시키고, 신경성 염증을 막고, 인지저하를 막아준다. (ref 5).
그 외에도 g377-395 펩타이드는 AbPP/PS1 동물모델에서 염증에는 변화없이 아밀로이드b의 침전을 감소시키고 인지기능을 향상 시킨다는 결과가 있다. (ref 6) 전체적으로 유전학적 약리학적인 증거자료들은 CNS에서의 피브린 (또는) 피브리노겐의 병원인적인 역할을 드러내는데 이런 것들은 신경계 적인 질환에서의 치료적 효과를 낼 수 있는 타겟임을 알려준다. 피브리노겐(피브린) 침전의 사례들은 정리하면 아래 Figure 3과 같다.

Figure 3. AD에서 피브린(피브리노겐)침전의 사례들 (ref 1)
고해상 공촛점(high resolution confocal) 그리고 멀티포톤 이미징(multi-photon imaging)에 의해 관찰하면, AD 동물모델에서 BBB내에서 피브린이 시간이 경과함에 따라서 발생할 수 있는 미묘하거나 집중된 파괴를 예민하게 감지할 수 있다. 형광라벨이 붙어 있는 피브리노겐을 EAE가 진행중인 살아있는 생쥐에게 혈관주사를 한 후 BBB가 파괴되고 척수에 피브린 침전이 생기는 것을 모니터 할 수 있다.
신경계 염증, 신경계 퇴행, 두뇌 외상에 있어서 발생하는 혈관계의 병리는 BBB 파괴와 혈액응고 연쇄반응이 피브리노겐과 피브린을 매개로 하여 (1)작용기전, (2)이미징, (3)치료제 쪽으로 관련 있다. 기전 적으로는 신경교세포, 신경세포, 면역세포, 혈관세포와 관련이 있다. 이미징은 in vivo 이미징과 분자 탐침(probe) 개발과 관련이 있으며, 치료제는 CNS로의 타겟팅, 동물모델, 바이오마커와 관련 있다. 신경계질환에서의 피브리노겐에 대한 연구방법론은 (1)약리학적인 도구로는: (a) 피브리노겐을 감소시키는 앤크로드(ancrod), 바트록소빈(batroxobin), (b)피브린 형성 저해제인 히루딘(hirudin)이 있고, (c)인테그린 수용체 등 다른 단백질과의 피브린 상호작용 저해제인 g377-395 펩타이드와 RU-505가 있다. 실험동물 모델로는 피브리노겐 유발성 뇌척수염 모델과 입체적 대뇌피질 피브리노겐 주사에 의한 모델이 있다.
본 연구에 대한 향후의 확장성이 필요한 부분을 요약하면
1) CD11b/CD18 이외의 타겟 들과의 상호작용에 대한 추가규명
2) CNS내 피브리노겐의 기전에 작용점인 세포 타겟들은 무었인가?
3) MS와 AD 이외의 BBB파괴에 피브리노겐의 역할은?
4) 피브리노겐의 실험동물계에서의 POC를 임상에 적용가능한가?
등이 있는데 이런 질문들은 이미 개발된 약리/실험의 동물적인 도구들에 의해 추가 규명되리라 예상된다.
참고로 현재 피브리노겐-CD11b 저해제나 피브린-Ab 저해제는 임상시험에서 시도된 적이 없다.
Reference
1. Petersen, M. et al. Fibrogen in neurological diseases: mechanisms, imaging and therapeutics. Nature Rev. Neurosciences 19. 283 (2018)
2. Davalos, D. et al. Fibrinogen-induced perivascular microglial clustering is required for the development of axonal damage in neuroinflammation. Nat. Commun. 3, 1227 (2012).
3. Paul, J., Strickland, S. & Melchor, J. P. Fibrin deposition accelerates neurovascular damage and neuroinflammation in mouse models of Alzheimer’s disease. J. Exp. Med. 204, 1999–2008 (2007).
4. Cortes-Canteli, M. et al. Fibrinogen and β-amyloid association alters thrombosis and fibrinolysis: a possible contributing factor to Alzheimer’s disease. Neuron 66, 695–709 (2010)
5. Ahn, H. J. et al. A novel Aβ-fibrinogen interaction inhibitor rescues altered thrombosis and cognitive decline in Alzheimer’s disease mice. J. Exp. Med. 211, 1049–1062 (2014).
6. Aso, E., Serrano, A. L., Munoz-Canoves, P. & Ferrer, I. Fibrinogen-derived g377-395 peptide improves cognitive performance and reduces amyloid-β deposition, without altering inflammation, in AβPP/ PS1 mice. J. Alzheimers Dis. 47, 403–412 (2015).
이전
2018.04.25
다음
2018.06.27