나파모스타트: 코로나19 살상 능력을 렘데시비르보다 600배 가졌지만…
배진건 (倍進바이오사이언스 대표)
코로나19가 시작한 순서대로 중국, 한국에 이어 유럽, 미국과 전 세계가 신약개발에 나서고 있다. 그러나 빠른 시간 안에 치료제 신약개발은 거의 불가능하기에 그래도 상대적으로 시간을 단축시킬 수 있는 ‘약물 재창출(Drug Reposition)’을 시도할 수밖에 없다.
렘데시비르는 길리어드가 에볼라 치료제로 개발하다 중단한 항바이러스제로 당연히 마땅한 치료제가 없는 코로나19에 가능성 있는 ‘약물 재창출’의 선봉장이 되었다. 먼저 실험실에서 살상 효과를 인정받으면서 미국, 중국 등지에서 대규모 임상이 진행되었다. 그 결과물로 미국에서 코로나19 표준치료제로 처음으로 인정받은 렘데시비르가 태어났다.
그러기에 코로나19를 타겟으로 앞으로 개발되는 약물들의 목표는 렘데시비르보다 바이러스 사멸효과가 우수하고 또한 안전성을 인정받는 것이다. 더 좋은 약물 재창출 연구의 일원으로 한국파스퇴르연구소(IPK)는 혈액 항응고제 및 급성 췌장염 치료제의 성분인 '나파모스타트'가 코로나19 바이러스의 감염을 억제하는 항바이러스 효능을 가졌다고 5월 14일 밝혔다.
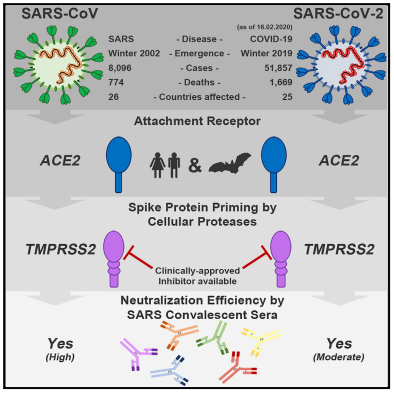
왜 ‘나파모스타트’가 관심을 끄는가? 한국에서 신약으로 만들어져 발매하고 있는 중에 ‘약물 재창출’로 외국에서 COVID-19로 임상 3상을 진행한다는 약물과는 달리 작용기전이 분명하다. 코로나19가 세포 진입 시 스파이크 단백질을 활성화하는 과정에서 TMPRSS2라는 단백질 분해효소가 작용한다. Markus Hoffmann 등은 4월 16일 자 ‘Cell’에 SARS-CoV-2가 숙주 세포에 들어갈 때 ACE2와 SARS-CoV-2의 결합을 돕기 위해 TMPRSS2의 참여가 필요하다는 논문을 발표했다. (Hoffmann et al., 2020, Cell 181, 271–280 April 16, 2020 https://doi.org/10.1016/j.cell.2020.02.052)
발표된 연구결과를 바탕으로 IPK는 TMPRSS2 억제 약물인 ‘나파모스타트’의 항바이러스 효능을 본격적으로 연구했다. IPK가 SARS-CoV-2 세포배양 실험을 통해 분석한 결과, ‘나파모스타트’가 약 3,000여종의 약물 중 코로나19에 대한 가장 강력한 항바이러스 효능을 가졌다. 바이러스 감염의 50%를 억제하는 약물의 농도(IC50) 수치만으로 단순 비교하면 ‘나파모스타트’의 IC50 수치가 렘데시비르와 비교 시 600배(2.2 nM vs. 1.3 mM) 우수한 수준이다. 연구결과는 논문 사전 게재 사이트인 바이오 아카이브(bioRxiv)에 5월 12일 공개됐으며, IPK는 이번 연구 결과를 바탕으로 나파모스타트에 대한 특허를 지난달 4월 20일 출원했다.
특히 이번 연구는 코로나19 바이러스 연구에 일반적으로 활용되는 원숭이의 신장 세포 대신 사람의 폐 세포를 활용해 항바이러스 효능을 분석하고 결과를 비교 검증했다. 코로나19에 대한 살상 효과만 본다면 지금까지 보고된 약물 중에 가장 강력한 것이다. 이번 연구결과를 바탕으로 국내에서는 10개 병원이 참여한 연구자 임상시험이 식약처의 승인을 거쳐 수행되고 있으며 또한 이탈리아, 일본 등 해외에서도 임상시험이 진행 중이다. 현재 국내외에서 ‘나파모스타트’ 관련 COVID-19 임상연구가 진행 중인만큼, 향후 임상에서의 효능 확인을 통해 실제 치료제로 사용가능 여부가 주목되고 있다.
우리가 먹는 약이 우리 몸 속에서 어떻게 움직이어 작용하는가? Pharmacokinetics(PK)는 고대 그리스어로 약물을 의미하는 pharmakon과 움직임을 의미하는 kinetikos의 합성어이다. 약물동태(藥物動態)는 특정 약물이 투여된 이후에 생체가 그 약물의 흡수, 분포, 대사, 배설과정을 동역학적 관점에서 해석하고 예측한다. 약물동태학은 약물동력학(pharmacodynamics)과 함께 연구되는 경우가 많은데 약물동력학은 약물이 생체에 미치는 약리학적 영향에 대한 연구이다. 약물의 효과가 제일 처음으로 중요한 요소이지만 PK는 ‘약물 재창출’에서도 굉장히 중요한 요소이다. 투여되는 약물은 체내에서 약리 활성을 나타낸 후 체외로 빠져나가야 한다.
시험관에서 아무리 좋은 효과를 나타낸 물질이라도 동물에 투여 후 충분한 혈중 농도를 지속적으로 유지하지 못한다면 약으로의 가치를 잃게 된다. 아무리 좋은 in vitro 효과를 보여주어도 바람직하지 못한 PK 특성 때문에 많은 약물 개발자들은 물질의 PK 특성을 개선하여 더 좋은 물질을 도출하기 위해 다양한 노력을 기울인다. PK/PD의 이런 특성을 잘 나타내는 좋은 예가 바로 ‘나파모스타트’라고 생각한다.
나파모스타트 메실레이트(Nafamostat mesilate, NM)는 중환자의 신장 기능을 대신하는 지속적 신대체요법(Continuous Renal replacement therapy, CRRT) 항응고제로 사용해왔으며, 2019년 9월부터는 혈액투석 환자 중 수술 전·후, 출혈, 저혈소판 환자에도 사용 중인 주사제다. 나파모스타트는 세린 프로테아제(Serine Protease) 저해제로서 반감기가 5~8분으로 매우 짧다. 그러기에 필요한 필터와 혈액투석기 내에서만 항응고 작용을 하고, 환자 전신에는 영향을 거의 미치지 않는다. 치고 빠지는 것이 중요하기에 주사 투여 종료 후 15분 후에는 체내에서 검출조차 되지 않기에 안전성이 높다.
TMPRSS2는 세린 프로테아제이다. 또한 이 효소저해제는 분자량이 낮아서 체외 순환을 통해 신체로부터 쉽게 배출될 수 있다는 특징이 있다. 반감기가 이렇게 짧아도 나파모스타트 메실레이트는 혈액 응고제 IX, X, XIIa 및 VIIa에 작용하여 항응고 효과를 나타내는 것으로 알려져 있어, 혈전증 치료제 또는 항 응고제로 광범위하게 사용되고 있다.
‘나파모스타트’가 관심을 끄는 이유는 긴급사용 승인을 받은 렘데시비르보다 '나파모스타트'는 세포수준에서 600배 높은 항바이러스 효과를 보였기에 더 낮은 약물 농도에서 바이러스 감염을 효과적으로 억제할 수 있다. 또한 '나파모스타트'는 현재 혈액 항응고제와 항염증제로 사용 중임으로 코로나19 임상에서의 효능이 확인된다면 바이러스의 세포 진입을 막고 코로나19 폐렴의 주요 병리인 혈전 등의 증상 개선에 일석이조의 치료 효과가 있을 것으로 기대 된다. ‘나파모스타트’가 이렇게 멋진 ‘약물 재창출’을 통하여 코로나19 종식에 일조할 수 있기를 간절히 바란다. 그러나 염려되는 짧은 반감기 동안에도 바이러스 살상효과와 혈전 등의 증상 개선이 가능할까? 우리는 임상 3상 결과를 기다릴 수밖에 없다.
지금 우리가 무엇을 할 수 있을까? 앞으로 다가올 새로운 코로나 바이러스가 (그 명칭이 코로나22던지 코로나24던지) 온 세상 사람을 심히 괴롭히기 전에 미리 약물을 준비하는 것이다. 세포수준에서 ‘나파모스타트’처럼 높은 항바이러스 효과를 가지고 있으면서 PK가 월등히 좋아 하루에 한번 약물을 투여하여도 바이러스를 사멸할 수 있는 약물을 연구개발을 통하여 미리 준비하여 최소한 임상 1상까지는 개발절차를 마친다면 코로나22(24)가 전파되는 긴급상황에서 바로 임상 2상을 진행할 수 있도록 준비하는 것이다. 이런 준비 외에는 아무리 따져보아도 앞으로 다시 공격해 올 코로나 바이러스에 다른 방법이 없는 것 같다. 누가 이런 물질을 준비하고 투자할 것인가? 민간 단체(혹은 제약회사)와 정부가 합력하여 선을 이루는 수밖에 없는 것 같다. 이번 코로나19로 잔 세계가 경제적인 어려움을 겪으면서 미리 준비된 방어가 최선의 무기인 것을 절실히 깨닫는다.
TMPRSS2 (transmembrane protease, serine 2) is a member of the type II transmembrane serine proteases, a family of 17 serine proteases that are characterized by a short cytoplasmic N-terminal domain, a single transmembrane domain, and an extracellular C-terminal domain containing the serine protease domain (1–3). TMPRSS2 is predominantly expressed in the luminal cells of the prostate epithelium, where its expression is positively regulated by androgens (4–7). Despite the high prostate-specific expression levels, the exact physiological function of TMPRSS2 in this tissue remains unclear.
*위 기고문은 메디게이트 기고문을 전제함
이전
2020.07.29
다음
2021.01.07