선도물질 및 후보 선정을 위한 탐색적 독성학 (Exploratory Toxicology)
숙명여자대학교 장민선
-
-
신약개발에서 독성 평가의 의미
1990년대 이후 체내동태 파라미터가 진일보된 신물질의 개발이 가능해진 이후, 부적격한 체내동태 (흡수-분포-대사-배설) 양상으로 인한 약물의 개발중단은 가히 놀랄 만큼 줄어들게 되었다.
1 하지만 개선된 흡수율을 가진 약물의 경우, 전신흡수의 증가로 인하여 개발을 심각하게 제한하는 독성이 발현되는 사례도 증가하게 되었다. 이러한 독성은 비가역적이거나 모니터가 불가능한 독성을 뜻하며, 이러한 약물들은 개발이 불가능한 안전역 (Safety margin)을 보이거나 승인 이후에도 약물의 시장가치에 부정적인 결과를 얻게 된다. 이렇듯, 약물개발 중단의 여러 원인 중 독성발현은 여전히 모든 개발 단계에서의 중요한 원인이 되고 있다.
신물질을 비롯한 여러 의약품의 전임상 독성평가의 주된 목적은, 사람과 연관성이 있는 독성을 규명하는 것과 사람의 독성을 적절히 예측할 수 있는 또는 예측할 수 없는 전임상 동물종에서의 독성을 연구하는 것이다. 이러한 전임상 독성평가는 사람에서 발현될 수 있는 잠재적인 독성을 초기에 규명할 수 있는 주요한 수단으로 인식되어지고 있다.
2, 3
의약품의 독성 평가 연구는 물질의 개발 단계에 따라서 규제독성 (Regulatory toxicology) 및 탐색독성 (Discovery toxicology) 연구의 두 가지로 나눌 수 있다. 후보물질 선정 이전에 실시하는 시험을 탐색독성연구라 할 수 있으며, 규제독성은 선정된 후보물질에 대하여 개발 측면에서 수행하는 것이다. Good Laboratory Practice (GLP) 규정을 따르고 시험방법이 정형화되어 있으며 독성에 관여하는 용량을 찾아내는 규제독성시험과 달리 탐색독성연구는 GLP를 반드시 적용할 필요가 없으며 연구 및 접근방법이 매우 유연하다. 탐색독성연구는 선도물질의 선정 이전부터 매우 초기에 이루어질 수 있다. 초기의 탐색독성연구를 통해 독성 발현 여부, 독성 발현 기작, 약물의 약리작용과의 연관성 등에 관한 정보를 확보할 수 있다. 따라서 이를 통해 선도물질 및 후보물질의 선정 과정의 효율을 가속화시킬 수 있을 뿐 아니라, 보다 안전한 물질을 개발할 수 있는 장점이 있다.
-
초기 개발 단계에서의 독성평가의 중요성
전형적인 신물질 후보 과정은 hit 발견 – hit to lead – lead optimization – candidate selection 등의 일련의 순차적인 과정을 포함한다. 이 네 가지의 과정을 탐색 (Discovery) 이라 하며, 선정된 후보물질에 대하여 보다 전문적이고 규제가 포함된 연구는 개발 (Development) 과정에서 이루어진다. 후보물질이 선정되는 순간 탐색과 개발이 업무적으로 뚜렷이 분리되는 경우가 비일비재하였고, 탐색과정 중의 적절하고도 심도있는 안전성 평가 (Safety assessment) 과정에 대한 중요성은 간과되어 온 게 사실이다. 하지만 독성이 개발중단의 가장 중요한 요인임을 감안하여, 최근에는 탐색 초기부터 안전성평가 연구가 활발히 진행되어 오고 있다.
탐색 초기에 이루어지는 독성평가의 중요성으로 말미암아, 독성학 분야에 Discovery toxicology, Investigative toxicology, Exploratory toxicology, Discovery pathology 등의 전문분야들이 속속 출현하였다. 이러한 연구의 공통적인 목적은 독성 발현의 여부 및 기작, 사람과의 연관성 등을 신약연구 초기에 밝혀내는 것이라고 할 수 있다.
-
탐색독성연구의 방법론
탐색독성연구는 그 시험 수행 및 결과 유출 속도, 독성 연구 대상, 독성 시험 수행 플랫폼 (
in vitro – in vivo) 등이 매우 다양하다.
In vitro 독성시험은 시험이 수행되는 시기와 목적에 따라 예상 (Prospective) 및 회고적 (Retrospective) 연구법으로 분류할 수 있다. 예상연구법은 단기간에 수행된
in vivo 독성시험에서 놓칠 수 있는 독성을 예측 가능하게 하는 것이다. 회고적연구법은 표적 장기 독성이
in vivo 연구에서 규명된 후, 예비후보물질들간에 프로파일을 규명하거나 독성 이슈가 출현하였을 때 관리하는 차원에서 수행되어진다.
예상연구법으로 수행되는
In vitro 독성평가방법론은 표 1에 간단히 정리하였다.
| 표 1. In vitro 예상독성평가법의 종류 |
| 평가법 |
수행 목적 |
시험의 종류 예시 |
| 유전독성 (Genetic toxicology) |
- 주로 In vivo 독성 시험 전에 수행
- 결과는 positive 또는 negative로 표현
- 안전역 개념과 상관없음
- 발암성 여부 예측
- 물질구조-독성 관계 (Structure-toxicity relationship; STR) 확립에 기여함
|
- Ames 시험 – 돌연변이성 확인
- 소핵 시험 – 염색체 이상 여부 확인
|
| 안전성약리학 (Safety pharmacology) |
- hERG 포타슘 채널에 대한 약물의 저해정도를 평가
- 심장 독성 예측
|
- hERG 억제 시험 (binding 또는 patch-clam assays) – QT 연장 가능성 예측
|
약물상호작용
(Drug-drug interactions) |
- 병용투여 약물에 대한 부정적인 영향력에 대한 평가
|
- Cytochomr P450 활성 저해 시험 – 약물 대사 영향 예측
- P-gp 저해 시험 – 약물 수송에 대한 영향 예측
|
대사체 유발 독성
(Metabolite-mediated toxicity) |
- 대사활성화 과정을 통하여 만들어진 활성 대사체 (reactive metabolite) 또는 친전자체 대사체 (electrophilic metabolite)는 유전독성, 표적 장기 독성, 특이체질적인 독성 등을 유발
- STR 확립
|
- Glutathione 포합체 형성 시험 – 친전자체 대사체 형성 예측
- 공유결합 형성 여부 연구 – 활성대사체의 형성 여부 예측
|
표적장기독성 (Target organ toxicity)는 약물 개발 중단의 가장 흔한 요인이나 통상적인
in vitro 독성평가시험에서 규명되어지지 못한다. 따라서, 초기탐색과정에서의
in vivo 독성 연구는 용량 상관성 있는 표적장기, 독성발현기작, 무독성 용량 등을 밝혀주는데 중요한 역할을 하는 분야이다. 여기서 얻어진 연구 결과는, 곧이어 수행될 엄청나게 비싸고 시간이 많이 소요되는 GLP 규제 독성 시험에 필요한 정보를 제공하게 된다.
In vivo 초기 독성평가시험에서 주목해야 할 것은 표적장기 및 독성발현기작을 규명하기 위한 분자적 또는 페노타입(phenotype)적인 신호를 보여줄 수 있는 독성시험을 개발하는 것이다. 이를 위해서는 knock-out (KO) mice 등을 사용하거나, 약리학적 작용기작에 기반한 바이오마커를 모니터링 하는 것이다. 독성발현의 기작을 신약개발 초기에 규명하는 이러한 탐색독성연구는 약물의 안전성 평가시험 개발 및 독성 이슈 관리 등에 중요한 역할을 하기 때문에 비용이 좀 들더라도 가능한한 수행하는 것이 좋다.
전임상독성 연구에서 발현되는 독성발현의 기작은 반응의 성격 및 관리 전략에 따라 다음 세가지로 분류할 수 있다 (표 2).
| 표 2. 전임상 독성의 분류 |
| 독성 분류 |
정의 |
예 |
이슈관리 |
1차적 약리학
(Primary pharmacology) |
- 약물의 약리학적 표적과 직접적인 상호작용
- 약물의 화학적 성질과 관련 없음
- Exaggerated pharmacology라고도 불림
- On-target toxicity의 일종
|
- ACE 저해제의 발생에 미치는 효과 : Ace-ko mice에서 비정상발생이 보여짐
|
- Black box warning: 4개월이후 임산부 복용 금지
|
2차적 약리학
(Secondary pharmacology) |
- 1차적인 효능 표적이 아닌 다른 표적과 상호작용하여 발현된 약리학적 독성
- 2차표적이 주로 1차표적과 연관되어 있으나, 규명하기 쉽지 않음
- Off-target toxicity에 해당함
|
- Fenfluramine: serotonin 2C receptor agonist로서 식욕억제제로 개발; serotonin 2B receptor와의 상호작용으로 심장 부작용
|
- Fenfluramine의 경우 시장에서 철회 (1997)되었지만, serotonin 2C-선택적 표적을 가지는 부작용이 없는 식욕억제제의 개발 진행
|
화학적 독성학
(Chemically mediated toxicity) |
- 약물의 화학적 성질에 기인한 독성으로서 산화 스트레스, 인지질증 (phosphor-lipidosis), 용혈 (hemolysis)등의 현상
- 약물이 포함하는 관능기에 의존적인 독성을 보여줌
|
- 말단 아세틸린 ( ): mechanism-based 약물대사효소 저해유발
- Policyclic aromatic hydrocarbons: DNA 변형을 통한 유전독성 유발
|
- Structure-activity relationship에서 사용하는 전략과 같은 동일한 방법을 사용하여 독성발현을 최소화함
|
단기간의 예비적인
in vivo 독성 시험은 용량제한적인 표적장기 독성을 발견하는데 매우 중요한 역할을 한다. 여기서 단기간이라 함은 단지 이틀일 수도 약 1주에서 2주일 수도 있다. 독성발현에 최소 10일 이상 소요되는 근육골격계 독성의 특수한 경우를 제외하고는, 많은 경우 5 ~ 7일 탐색독성 시험은 용량과 상관성있는 표적장기 독성을 발견하게 한다. 그리고 이러한 결과는 GLP 4-주 독성시험에서의 결과와 매우 상관성 있음이 보고된 바 있다.
4-6
초기에 진행되는 탐색독성연구는 discovery 또는 experimental pathology의 역할을 필요로 한다. 전통적인 독성병리학의 역할은 GLP시험에서 얻어진 결과를 해석하는 것이었지만, 탐색독성연구는 이러한 역할을 보다 광범위하게 확장시켰다. 의도되었건 의도되지 않았건 – 즉, on-target이건 off-target이건 – 특정 약리학적 표적과의 상호작용으로 유발된 독성은 Discovery pathology의 역할로 규명되어질 수 있다. 유전자조작 mice등 현대적인 동물 모델을 적절히 이용하여, 해당약물의 약리학적 표적과 관련된 독성에 관한 병리학적 해석들은 독성발현 기작을 규명하는데 매우 중요한 역할을 하고 있다.
7
탐색독성연구를 통해서 용량 상관적인 독성이 발견된 경우, 안전역을 설정하고 발견된 독성이 개발을 현저히 저해할 것인가에 대한 평가를 해야 한다. 본격적인 개발단계 이전에 수행되는 탐색독성 연구와 이 연구의 결과로부터 얻어진 독성과 관련된 의사결정단계는, 미래에 발생할 수 있는 엄청난 비용과 시간을 절약할 수 있는 중요한 단계가 될 것이다.
-
이슈 관리
독성연구 시험 등을 통해 독성이 발견되었다면, 이 독성에 관해 아래의 5가지 질문 (표 3)을 제시하고 그 해답을 찾아봐야 한다. 이 때, 모든 독성이 무시할 수 있는 것은 아니며, 또한 모든 독성이 개발을 심각하게 저해하는 것도 아님을 주지하여야 한다. 즉, 나타난 독성 이슈를 철저히 분석하여 상황에 대처하여야 한다. 표 3에 제시한 독성발현의 세 가지 주요기작에 근거하여, 독성출현의 이슈를 관리하는 방법은 그림 1을 참조한다.
8
| 표 3. 독성이슈 관리를 위한 5가지 질문 |
|
|
해석 |
- 안전역은?
|
- 치료영역, 환자군, 경쟁상황, 용량의존적 부작용인지에 따라 안전역의 크고 작음이 개발 가능성 여부를 판단하는데 도움이 됨
|
- 가역적인가?
|
|
- 모니터 가능한 바이오마커가 있는가?
|
- 있다면 개발 가능할 수도 있음
- 없는 경우의 독성은 비가역적일 확률이 매우 높음. 따라서 개발 가능성 낮음
|
- 독성 기작은?
|
- 독성기작이 비임상시험 동물 종-특이적인지 확인해볼 필요 있음
- 사람과 관련이 없는 독성 기작이라면 개발 가능성 있음
|
- 사람과의 연관성은?
|
- 관찰된 독성이 기작 관련성, 용량의존성, 치료영역 등에 의해 판단해볼때 사람에서의 연관성이 있는지를 종합적으로 판단함
|
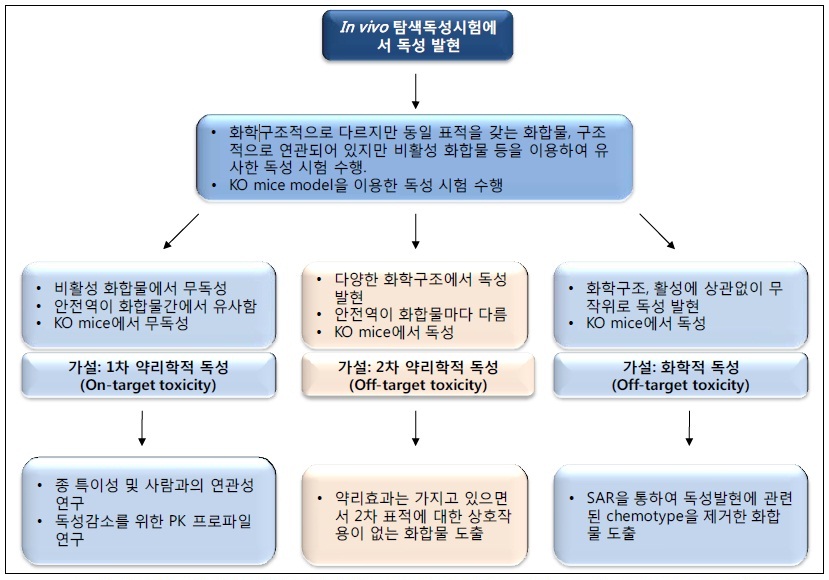 그림 1. 독성 이슈 관리를 위한 결정단계도. 독성 신호를 규명할 수 있는 in vivo model을 이용한 시험에서 용량상관성 있는 독성이 발견되었을 경우, 독성의 본질을 이해하려는 노력을 수행하여야 한다. 독성의 본질은 약물의 약리학적 표적과 관련이 있을 수도 있고 없을 수도 있음을 주지하고, 위에서 제시한 3가지 종류 중에 한 가지에 해당되는지를 mechanistic 연구를 통해 분류한다. 이러한 Investigative toxicology 노력을 통해 독성의 본질이 밝혀지면, 최적의 안전성/효능 프로파일을 가지는 후보물질을 도출하는데 그 연구결과를 적용한다.
그림 1. 독성 이슈 관리를 위한 결정단계도. 독성 신호를 규명할 수 있는 in vivo model을 이용한 시험에서 용량상관성 있는 독성이 발견되었을 경우, 독성의 본질을 이해하려는 노력을 수행하여야 한다. 독성의 본질은 약물의 약리학적 표적과 관련이 있을 수도 있고 없을 수도 있음을 주지하고, 위에서 제시한 3가지 종류 중에 한 가지에 해당되는지를 mechanistic 연구를 통해 분류한다. 이러한 Investigative toxicology 노력을 통해 독성의 본질이 밝혀지면, 최적의 안전성/효능 프로파일을 가지는 후보물질을 도출하는데 그 연구결과를 적용한다.
-
-
결론
신약개발 단계 중 매우 초기에 통합적으로 이루어지는 탐색적 독성연구는 보다 우수한 안전성/약효성 프로파일을 가지는 후보물질을 도출하는데 큰 공헌을 할 것이다. 물질의 약리작용기전, 투여경로, 독성발현기전 등에 대한 기본적인 지식을 바탕으로, 탐색독성연구계획을 지속적으로 개발하고 시험을 진행하여야 한다. 그리고 탐색병리학자 (Discovery pathologist) 등을 포함한 전문가의 해석을 통하여 독성학적인 측면에서 개발물질의 가치를 최대한 정확하게 평가하는 노력을 기울여야 한다. 또한, 모든 약은 잠재적으로 특정 노출 수준에서 독성일 수 있다. 따라서, 독성의 발현과 개발 진행의 결정 과정에는, 연구대상 물질의 안전역, 독성의 본질 (비가역성, 독성 바이오마커 여부), 투여 경로, 투여 기간, 적응증, 사람에서 발현될 확률 등을 고려하여 독성학적 이슈를 관리하여야 한다. 이것이 실패율을 줄일 수 있는 신약개발에서의 독성평가라고 할 수 있다.
참고문헌
1. Reichert, J.M. Trends in development and approval times for new therapeutics in the United States. Nat. Rev. Drug Discov. 2003, 2(9), 695-702.
2. Olson, H. et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharmacol. 2000, 32(1), 56-67.
3. Greaves, P., A. Williams, and M. Eve, First dose of potential new medicines to humans: how animals help. Nat. Rev. Drug Discov. 2004, 3(3), 226-36.
4. Renkiewicz, R. et al. Broad-spectrum matrix metalloproteinase inhibitor marimastat-induced musculoskeletal side effects in rats. Arthritis Rheum. 2003, 48(6), 1742-9.
5. Kramer, J.A. et al. Transcription profiling distinguishes dose-dependent effects in the livers of rats treated with clofibrate. Toxicol. Pathol. 2003, 31(4), 417-31.
6. Elrick, M.M. et al. Differential display in rat livers treated for 13 weeks with phenobarbital implicates a role for metabolic and oxidative stress in nongenotoxic carcinogenicity. Toxicol. Pathol. 2005, 33(1), 118-26.
7. Alden, C.L. et al. The pathologist and toxicologist in pharmaceutical product discovery. Toxicol. Pathol. 1999, 27(1), 104-6.
8. Kramer, J.A., J.E. Sagartz, and D.L. Morris, The application of discovery toxicology and pathology towards the design of safer pharmaceutical lead candidates. Nat. Rev. Drug Discov. 2007, 6(8), 636-49.
