Long-Acting Fc Fusion Protein 기술을 적용한
호르몬 결핍증 치료제 개발 및 기술이전
김태경 상무, 제넥신
MAKE INCURABLES CURABLE
1997년 IMF 이후, 경제 위기 극복을 위해 국가적 차원의 바이오산업 지원이 활성화 되었다. 1998년 38건에 그쳤던 바이오 벤처기업 설립 건수가 1999년 91건, 2000년 224건으로 폭발적으로 증가 했다. 당사 역시 1999년 바이오 붐에 태어난 회사이다. 제넥신은 불치병 및 난치병을 치료하는 신약을 개발하여 인간 삶의 질을 개선한다는 미션을 가지고 POSTECH(구 포항공대) 학내 벤처로 시작되었다. 면역학을 연구한 성영철 교수(설립자 및 現 제넥신 회장)는 인체의 면역반응을 이용한 DNA 백신기술과 외부에서 주입되는 치료제에 대한 면역반응을 최소화 시키고 약물의 지속성을 향상시키는 항체융합단백질 원천기술(hybrid Fc fusion protein)을 연구하였다. 다른 벤처기업들이 바이오 기술의 사업화에만 집중했다면, 제넥신은 다양한 물질에 적용이 가능한 원천기술을 개발하여 적용 가능성을 무한으로 넓혔다.
현재 바이오의약품의 연구 동향은 약물의 생체 내 활성도를 증진시켜 반감기를 증가시키는 방향으로 접근하고 있다. 기존의 insulin, EPO, G-CSF 등 1세대 재조합 단백질 제제의 경우 Pegylation, Fc Fusion, Albumin Fusion, Glycosylation 등의 지속형 기술을 통해 시간 단위 (hour-based) 의 짧은 반감기를 주 단위 (week-based) 로 증가시켰다. 대표적인 예로, 주3회 투여 하던 Amgen사의 1세대 EPO는 Glycosylation 기술을 적용하여 주 1회 제형으로 개발 되었다. 이는 기존의 1세대 제품을 대체했을 뿐만 아니라 약 2조 원의 시장 규모를 10년 사이에 4배 이상 확대하여 시장성을 인정받기도 하였다.
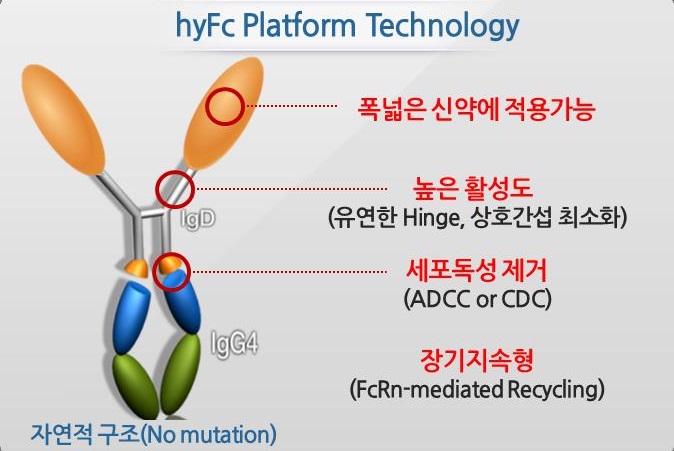 Fc Fusion technology 역시 의약품 개발의 전 단계에서 활발히 사용되고 있는 기술이며 antagonist에 적용한 제품들은 상용화에 이르렀다. 그러나 EPO, G-CSF, hGH 등의 agonist protein에 적용할 경우 세포독성 (ADCC & CDC)으로 인해 타겟 세포의 사멸을 유도하므로 적용하기 어렵다는 단점이 있다. 반면, 제넥신은 기존의 인공적인 지속형 기술과는 달리, 유전자 변이 없이 체내 존재하는 항체를 이용하여 반감기는 증가시키고 세포 독성을 유도하지 않도록 설계하여 안전성을 확보하였다. ‘체내에 들어가는 물질은 체내로부터 유래되어야 한다’는 이념이 통하였던 것이다. 현재 제넥신은 hyFc 기반 기술을 활용하여 성장호르몬 결핍증, 만성 신부전증으로 인한 빈혈증, 호중구 감소증, 림프구 감소증 등의 적응증을 대상으로 치료제를 개발하고 있으며 이는 모두 임상시험을 진행 중이다.
Fc Fusion technology 역시 의약품 개발의 전 단계에서 활발히 사용되고 있는 기술이며 antagonist에 적용한 제품들은 상용화에 이르렀다. 그러나 EPO, G-CSF, hGH 등의 agonist protein에 적용할 경우 세포독성 (ADCC & CDC)으로 인해 타겟 세포의 사멸을 유도하므로 적용하기 어렵다는 단점이 있다. 반면, 제넥신은 기존의 인공적인 지속형 기술과는 달리, 유전자 변이 없이 체내 존재하는 항체를 이용하여 반감기는 증가시키고 세포 독성을 유도하지 않도록 설계하여 안전성을 확보하였다. ‘체내에 들어가는 물질은 체내로부터 유래되어야 한다’는 이념이 통하였던 것이다. 현재 제넥신은 hyFc 기반 기술을 활용하여 성장호르몬 결핍증, 만성 신부전증으로 인한 빈혈증, 호중구 감소증, 림프구 감소증 등의 적응증을 대상으로 치료제를 개발하고 있으며 이는 모두 임상시험을 진행 중이다.
성장호르몬 결핍증이란?
항체융합단백질 원천기술을 적용한 대표적인 파이프라인이 바로 GX-H9 지속형 성장호르몬제이다. 인성장호르몬은 뇌하수체에서 분비되는 호르몬의 일종으로 인체의 성장과 발달 및 단백질 합성과 아미노산 흡수를 촉진시키는 중요한 물질이다. 우리 몸의 간에서는 인슐린 유사 성장 인자 1(IGF-1)가 생산되는데, 이때 IGF-1은 근육과 뼈를 포함한 다양한 조직에 전달되어 성장을 유도한다. 주로 청소년 및 성장기에 활발히 분비되고 15~30세 사이에 최적의 수준을 유지하다가 나이가 들어감에 따라 감소하게 된다. 성장호르몬 발견 초기에는 사체의 뇌하수체로부터 직접 분리해야 하는 매우 고가의 호르몬 제제였으나, 1981년 미국 Genentech사에서 유전자 재조합 기술을 통해 대장균에서 합성한 Somatotropin을 출시하며 대중화되기 시작했다.
성장호르몬은 다양한 질환의 치료제로 사용되지만 그 중에서도 성장호르몬 결핍증이 발병율과 시장규모 측면에서 큰 부분을 차지한다. 성장호르몬 결핍증은 성인과 소아로 구분된다. 성인의 경우 뇌종양, 뇌출혈 등으로 인해 방사선 치료나 수술을 받을 경우 뇌하수체가 손상되며 호르몬 분비 장애가 발생하고, 이로 인해 사회적, 정신적, 육체적 에너지 감소(근육량, 골밀도 감소, 체지방, 콜레스테롤, 심장 질환 발생률 증가)를 겪게 된다. 소아의 경우 뇌하수체 손상 또는 발달 장애로 인해 성장호르몬 분비장애가 발생하며, 신장이 또래의 성장 곡선에서 하위 3% 또는 한해 5cm 이하 성장 시 저신장증으로 판단 되는 상태이다. 환자 발병율의 경우 7대3 비율로 성인 환자가 많지만 시장성 측면에서는 4.2조 원 규모 중 86%가 소아 환자로부터 발생한다. 세계 주요 성장호르몬 개발사들이 소아 치료제에 집중하는 것도 이러한 이유에서 기인된다.
소아 성장 호르몬의 주요 치료대상 연령대는 5-12세이며 평균 치료 기간은 3.6년이다. 현재 시판되어 있는 1세대 성장호르몬은 치료 기간 동안 매일 주사하여야 하는 불편함으로 인해 투여 불이행 문제가 빈번히 발생하며, 이는 성장을 저해하는 가장 큰 요인으로 확인되었다. 이를 해결하기 위해, 1세대 제품을 보유한 글로벌 제약사들이 지속형 개발에 도전하였으나 낮은 효능, 부작용, 제조 문제 등으로 실패하였다.
GX-H9, 성장호르몬 결핍증 치료제 개발
개발 초기 human growth hormone (hGH) receptor와 GX-H9에 대한 결합력 분석을 측정한 결과, 시판되어 있는 성장호르몬에 비해 높은 binding affinity를 보여주었다. 이후 당사는 범부처 신약개발사업단의 제 1호 지원과제로 선정되어 동물모델에서 효능, PK/PD 및 독성을 실험하였고, 주1회 투여하였을 때 매일 투여한 1세대 제품과 유사한 성장판 증가와 체중 증가를 확인하며 환자들의 편리성을 증가시킬 수 있는 지속형 성장호르몬의 가능성을 확인하였다. 2013년 유럽에서 본격적으로 임상 1상에 착수하며 건강 성인을 대상으로 단계적 중량에 따른 안전성, 내약성 및 PK/PD 평가를 진행하였다. 그 결과 SAE (Serious Adverse Event) 및 ADA (Anti-Drug Antibody) 가 단 한 건도 발생하지 않아 안전성의 확신을 갖게 되었을 뿐만 아니라 소아 임상 시험 승인에 긍정적인 영향을 미쳤다.
1상 이후, GX-H9의 개발에 속도를 내기 위해 지속형 단백질 의약품을 잘 이해하고 있는 외부 컨설턴트를 적극 활용하였다. 소아 환자가 주 시장 규모를 형성하고 있는 관계로 소아환자에서 효능을 빠르게 평가함과 동시에 기존 개발 중인 제품 대비 우월성을 확보할 수 있는 전략을 수립하여 현재 소아 및 성인 환자를 대상으로 유럽 및 국내 임상 2상을 진행하고 있다.
지난 4월, GX-H9은 세계 최대 내분비학 학회인 ENDO 2016에서 Late-Breaking Poster 발표로 선정된 바 있다. 금번 학회에서 제넥신은 건강 성인을 대상으로 진행한 임상 1상 결과와 성장호르몬 결핍증 성인 환자를 대상으로 한 임상 2상의 중간 결과를 발표하였는데, 특히 안전성과 월2회 제형의 가능성에 많은 이들이 관심을 집중하였다. 0.1mg/kg (주1회 제형) 과 0.3mg/kg (월2회 제형)으로 나누어 진행 중인 임상2상의 IGF-1 SDS 수치를 확인한 결과 월 2회 제형의 충분한 가능성이 확인되었다.
중국 Top 10 제약회사, Tasly Pharmaceuticals와 GX-H9 포함한 기술 이전 계약 체결
제넥신의 사업적 목표는 단연 글로벌 라이선스 계약이다. 제넥신은 글로벌 라이선스를 추진하기 위해 다양한 신흥시장(emerging market) 사업을 추진하면서 축적된 개발역량과 사업역량을 바탕 하여 글로벌 계약을 추진 중이다. 제넥신이 많은 성과를 내어온 중국은 이미 단일국가 시장으로는 세계 2위를 상회하는 대형시장이며, 세계적 수준의 인재영입과 시설구축으로 개발역량이 급성장하고, 다양한 방식의 사업개발전략이 구사될 수 있는 특징적인 시장으로서, 제넥신의 중국 라이선스 아웃은 세계시장으로 가는 교두보가 될 수 있는 임상개발, 사업개발의 중요한 전기로 제넥신은 간주하고 있다. 중국은 i) 산업화로 인한 주거환경의 변화, ii) 국민 생활수준 향상으로 인한 질병유형의 서양화, iii) 고령화로 인한 의료비용 증가 등 다소 일반적인 요소 외에도 iv) 오랫동안 지속되어온 한 자녀 정책으로 인해 소아질환 치료에 대한 욕구가 특징적일 것으로 예상되어, 제넥신은 GX-H9의 주요한 시장으로서 중국 사업을 적극 추진해왔으며, 특히 해외에서 임상시험이 완료된 제품도 임상1상부터 재개해야 되는 중국 규제를 해결하고자, 시장 선점 전략으로서 중국 파트너사로서의 조기 기술이전 및 공동개발을 빠르게 진행한 것이다. 제넥신 파이프라인의 우수성을 전세계가 주목하고 있는 중국에서 우선 인정받았을 뿐만 아니라 글로벌 시장으로 나아갈 수 있는 발판을 미리 다져둔 것이다.
작년 10월, 당사는 중국 대표 Wellness 기업인 Tasly Pharmaceuticals (매출 2.3조원, 2015년) 와 JV를 설립하여 자체개발 진행중인 지속형 단백질치료제의 중국 판권을 이전하는 계약을 체결하였다. 계약 규모는 약 1,150억 원이었으며 이는 2015년 한해 국내 바이오텍 회사들 중 가장 큰 기술수출 규모였다. 본 계약을 통해 제넥신은 임상단계인 3종의 파이프라인 (GX-H9 성장호르몬 치료제 포함) 의 중국판권과 비임상 초기단계 개발 중인 2종에 대한 전세계 판권을 이전하며 중국 내 단백질 치료제 개발에 시동을 걸었다.
당사는 다양한 방식으로 추진해온 중국 사업노력 가운데, 확보된 네트워크에 기반해 Tasly측과 마주할 수 있었으며, hyFc 기반기술로 개발되어온 다양한 제품군은, 자본적 요소가 풍부한 가운데 바이오 의약분야를 집중 육성하고자 하는 업체에 효율적으로 호소될 수 있었다. 특히 이른 바 소황제(小皇帝)로 지칭되는 한 자녀 중심의 가족 문화는 GX-H9의 시장 잠재력을 도입후보 업체들이 호평하게 되는 중요 요소가 될 수 있었다. 이미 잘 알려진 바와 같이 중국과의 라이선스 계약은 임상시료의 중국 내 생산 가능여부를 요구하게 되는데, 상업목적생산 수준의 CMC를 1상부터 요구하는 CFDA 규정은, 이미 유럽임상을 통해 상당수준의 완성도를 가진 자사 GX-H9의 CMC 수준에 큰 어려움이 있지는 않았다. 자사는 본 계약을 통해, 단순한 라이선스 계약에 의한 수입기대 외에도, 중국 내 상당한 역량을 보유한 파트너사와 다양한 방식의 개발 협력을 기대하고 있다.
성장호르몬 치료제 전망과 제넥신의 미래
세계 성장호르몬 시장은 지속적으로 성장하고 있으며, 2013년 기준 약 35억 달러(약 4.2조 원)의 매출과 연간 5%의 성장률을 보이고 있다. 전문가들은 2018년 47억 달러(약 5.4조 원)의 시장으로 전망하고 있는 상황이다. 현재 미국, 유럽, 일본 등의 선진국이 전체 성장호르몬 매출의 88%를 차지하고 있으나 많은 환자 인구를 보유하고 있는 중국의 의료 산업과 국민 생활수준이 발전하고 있으므로 시장 성장은 긍정적으로 평가된다.
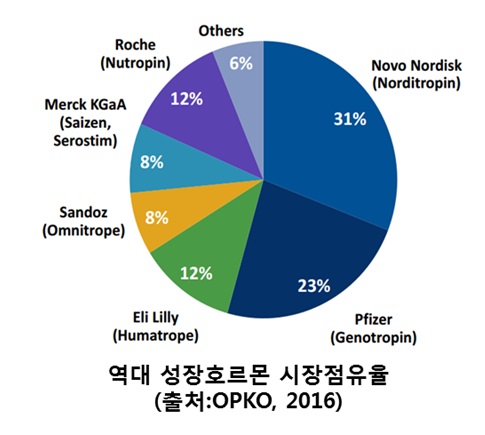 1세대 성장호르몬에 대한 바이오시밀러의 경우 TEVA, LG, Sandoz가 출시하여 기존 제품인 Norditropin, Genotropin, Humatrope 등과 경쟁하고 있으나 경쟁력이 약하여 낮은 점유율을 보이고 있는 형태이다. 2세대(지속형) 제품 개발에 대한 시도는 끊임없이 있었으나 CMC, 효능, 안전성 문제로 아직까지 시장에 성공적으로 출시된 제품이 없다.
1세대 성장호르몬에 대한 바이오시밀러의 경우 TEVA, LG, Sandoz가 출시하여 기존 제품인 Norditropin, Genotropin, Humatrope 등과 경쟁하고 있으나 경쟁력이 약하여 낮은 점유율을 보이고 있는 형태이다. 2세대(지속형) 제품 개발에 대한 시도는 끊임없이 있었으나 CMC, 효능, 안전성 문제로 아직까지 시장에 성공적으로 출시된 제품이 없다.
현재 제넥신을 포함하여 전세계 5개의 주요 개발사 (Versartis, Ascendis, Pfizer, Novo Nordisk) 들이 지속형 성장호르몬을 연구 중이며, 대부분의 개발사는 1주형 연구에 머물고 있으나, 당사와 Versartis는 월 2회제형을 개발함으로써 가치창출에 더 몰두하고 있다. XTEN, CTP, Albumin Fusion 등 다양한 기술을 이용하여 지속형 성장호르몬 제제를 개발하고 있으나 현재까지 글로벌 마켓에 성공적으로 출시된 제품은 없으며 미충족 수요에 따라 개발 경쟁이 치열하다. 따라서 환자에게 투여 compliance를 높이고 편의성을 제공함과 동시에 안전성과 가격 경쟁력, 그리고 1세대에 버금가는 효능을 지닌 지속형 성장호르몬 제품의 시장 성공확률은 보장되어 있다고 보아도 무방하다.
2014년 성장호르몬 개발사인 OPKO가 글로벌 제약회사 Pfizer와 $570M 규모의 지속형 성장호르몬제 기술수출 소식을 발표하였다. GX-H9은 제넥신의 hyFc 원천기술력을 기반으로 안전성과 효능이 우수한 1주형 개발뿐만 아니라 긴 반감기를 통해 2주형 제제도 개발 가능하기에 현재 개발 중인 지속형 파이프라인들과 차별화가 된다. 성장호르몬 치료제의 적응증 또한 무궁무진하다. 터너 증후군, 누난 증후군, Prader-Willi 증후군 등 호르몬 분비 장애로 인해 발생하는 다양한 질환에 적응증 확대가 가능하며 노화 방지, 피부 미용에도 활용이 가능한 팔방미인형 파이프라인이다. 현재 진행 중인 글로벌 성인 임상2상의 상세 결과와 소아 임상 2상의 top-line data를 기반으로 글로벌 라이선스 아웃을 추진할 예정이다.
이전
2016.07.04
다음
2016.09.09