“이 장벽을 허무시오”
범부처신약개발사업단 사업개발팀 김 용 연구원
(본 내용은 Nature Reviews Cancer, 2018년 4월호에 개제된 “Tear Down This Wall”의 내용을 바탕으로 작성되었다.)

출처: Carl Conway / Macmillan Publishers Limited
암이라는 질병은 상당히 무섭다. 항암치료의 부작용도 두렵다. 하지만, 그 이미지들은 날이 갈수록 바뀌고 있다. 바로 면역 항암제의 등장 때문이다. 암세포를 직접 죽이는 1세대 2세대 항암제와는 다르게, 3세대 항암제라 불리는 면역항암제는 환자의 면역시스템을 활성화 하여 암세포를 죽인다. 면역항암제는 1세대 항암제의 부작용과, 2세대 항암제의 내성 문제를 상당 부분 해결 했다. 대표적으로 여보이 (CTLA4 억제제), 옵디보 (PD-1 억제제), 키트루다 (PD-1 억제제) 등의 면역관문억제제 (Immune Checkpoint Inhibitor)가 시장에 나와있다. 이런 면역관문억제제들은 암세포의 면역 회피 신호를 억제하여 환자의 면역시스템이 암세포를 공격하게 만든다. 여러 장점을 가진 면역항암제는 항암제 시장의 왕좌를 차지하는 것은 시간 문제인 것으로 보인다.
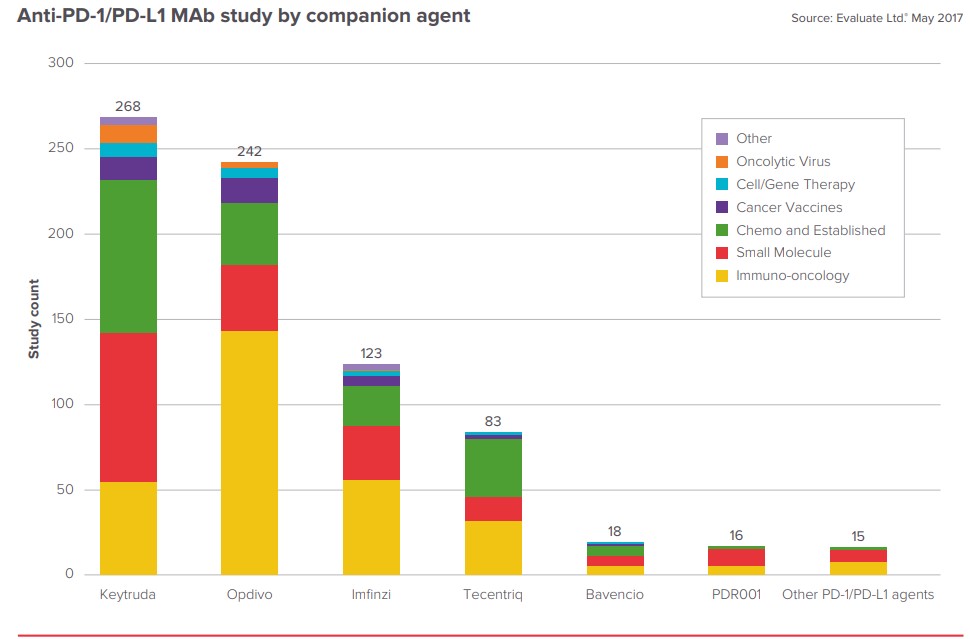
하지만, 뛰어난 효과의 면역항암제가 넘어야 할 산들은 아직 남았다. 일부 암종을 제외한 Overall response rate (ORR) 은 20%~30% 에 불가하기 때문이다. 따라서, 면역항암제를 통한 항암 치료율을 높이기 위한 여러 접근법이 시도되고 있다. 새로운 타겟 발굴 (LAG3, B7-H3, B7-H4, TIM3, OX40 등) 과 기존의 면역관문억제제와의 병용 연구가 그 예이다. 특히 병용 요법에 대한 연구가 매우 활발하다. 2017년 5월 기준, Clinicaltrials.gov에 등록된 anti-PD-1, anti-PD-L1 병용 연구는 765건이 진행되고 있다. Keytruda (MSD)와 병용요법은 268건이고, Opdivo (BMS)는 242건에 다다른다. (Figure 1)
Combination에 사용되는 약물도 다양하다. 기존에 존재하는 Chemical Drugs, Monoclonal antibodies 서부터, Cancer Vaccine, Oncolytic Virus, Cell therapy 등 새로운 접근법도 등장했다. 그리고 anti-PD-1과 anti-PD-L1 Combination therapy 에서 종양미세환경 (Tumor microenvironment target, TME)을 공략하는 것도 연구되는 분야 중 하나이다.
Figure 1. Anti-PD-1/PD-L1 병용 투여 연구 양상
최근 Nature Reviews Cancer 4월 호 Research Highlights에서 종양미세환경 관련 내용을 다뤘다. 종양미세환경이란 종양 주변에 신생혈관, 세포외기질, 섬유아세포 등이 존재하여 암세포가 잘 자랄수 있는 세포환경을 말한다. 이러한 환경은 암세포의 성장과 전이에 영향을 미친다. 또한, 종양미세환경은 면역관문억제제의 낮은 반응률과 연관이 있다고 알려져 있다. 즉, 종양미세환경의 변화는 ORR 20%의 면역항암제의 반응률을 높여줄 수 있다는 이야기다. 더 많은 환자가 암으로부터 자유로워 질 수 있을 것이다. 마치 지미 카터 전 미국 대통령이 그랬듯이 말이다.
Transforming growth factor-β (TGFβ)는 종양미세환경에서 발견되는 단백질 중 하나이다. Tauriello과 Mariathasan는 높은 TGFβ 발현이 Metastatic colorectal cancer (CRC) 과 Metastatic urothelial cancer (UrC)의 낮은 치료 반응률과 낮은 면역감시 (Immune surveillance)와 관련이 있다 말하고 있다.
Tauriello은 Invasive tumor 에서 T-cell infiltration이 되지 않았으며, 종양 margin에서 높은 stromal TGFβ의 발현을 확인했다. Mouse tumor organoids (MTO)를 mice에 이식 한 후, TGFβ receptor type 1 specific inhibitor (Eli-lilly, Galunisertib) 을 투여시, 종양의 크기와 섬유아세포에 대한 TGFβ의 반응은 줄어들고 (F-TBRS, TGFβ response signatures in fibroblasts), T-cell infiltration의 증가가 관찰되었다. (Figure 2)
Figure 2. TGFβ inhibitor 효과
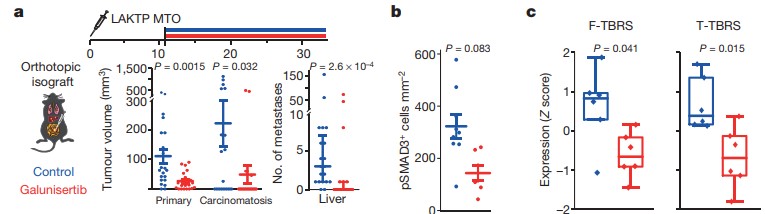
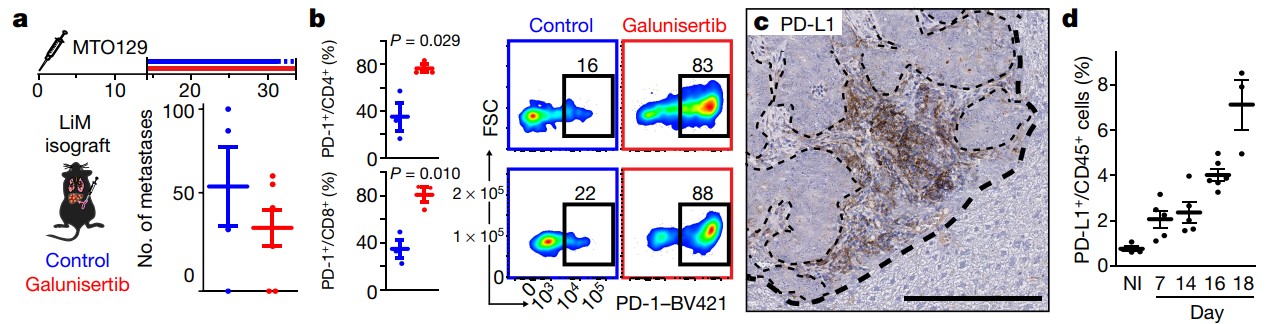
Figure 2에서 TGFβ 억제제로 항암 효과 및 전이 감소를 확인 할 수 있다. 하지만 MTO inoculation 14일 이후, Galunisertib 투여군을 확인한 결과 Complete remissions의 정도가 낮은 것이 확인된다. CD4+ T cells 과 T-bet+ lymphocytes가 증가했음에도 불구하고 mild 한 효과를 나타냈다. 그 이유는 무엇일까? Galunisertib 투여로 infiltration 된 T-cell에서 PD-1 발현이 증가되었으며 stromal PD-L1+ cell (Tumor associated macrophage, TAM) 을 recruit 되었다. TAM은 T-cell의 세포독성을 저해하며 종양의 성장을 유도한다고 알려져 있다. 결국 T cell infiltration은 되었지만 전체 항암 효과는 감소되는 것이다. (Figure 3)
Figure 3. TGFβ inhibitor 투여 후 T-cell에서의 PD-1 발현 증가 및 PD-L1 cell recruit 증가
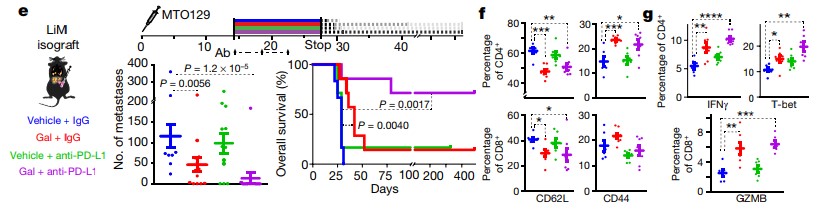
Galunisertib와 PD-L1 항체의 병용 투여는 이러한 mild 한 효과를 개선할 수 있다. Galunisertib과 PD-L1항체 병용 투여결과, 단독투여군 보다 IFNγ과 CTL의 Granzyme B (GZMB) 의 수치가 증가하였다. IFNγ는 M1 macrophage를 활성화 시켜 Tumor suppression 효과 보이게 된다. GZMB도 apoptosis를 유도한다. 또한, 투여 중단 후 관찰결과 1년이 넘는 Overall survival이 관찰되었다. (Figure 4)
Figure 4. TGFβ inhibitor 과 anti PD-L1 병용 투여시 효과 비교
종양미세환경에서 증가된 TGFβ의 양은 T-cell exclusion과 Th1-effector phenotype acquisition을 막는 immune evasion을 대변한다 볼 수 있다.
Mariathasan의 논문은 Anti-PD-L1 (atezolizumab) 투여 UrC 환자 코호트 연구를 통해 anti-PD-L1 responder와 Non-responder 환자의 biomarker를 분석 하였다. Anti-PD-L1 약물 반응군은 CD8+ Teff cells 관련 유전자의 높은 발현율과 높은 종양 변이부담 (Tumor Mutational Burden)을 가지며, 약물 미반응군의 TGFβ signaling pathway 관련 유전자 발현을 확인했다. (Figure 5)
Figure 5. Anti-PD-L1 투여 responder 과 non-responder 비교
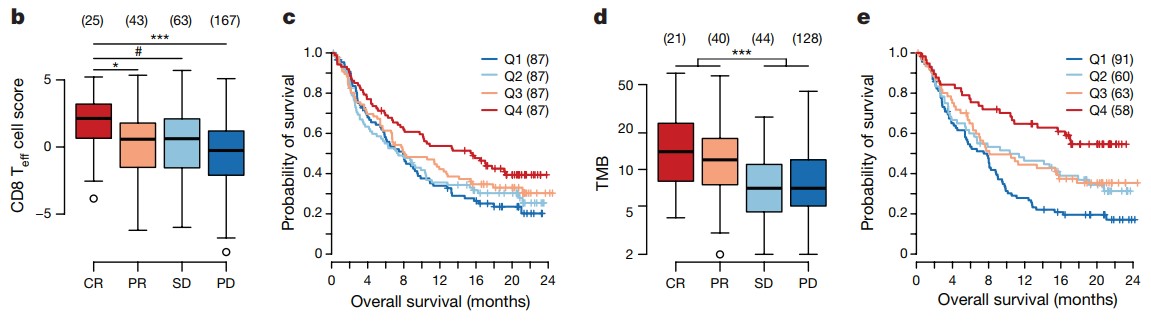
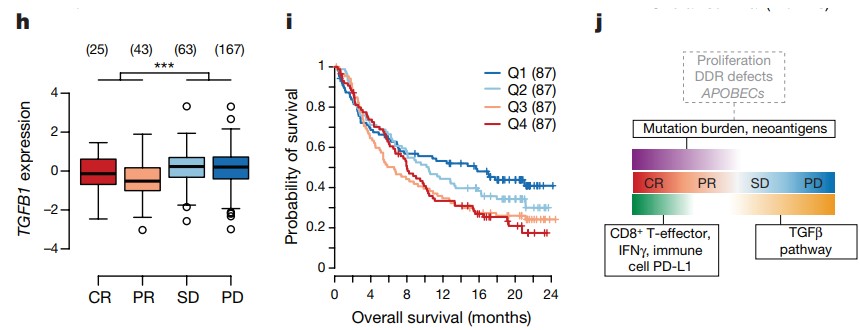
CR: Complete Response, PR: Partial Response, SD: Stable Disease, PD: Progressive Disease
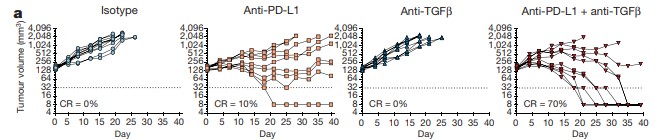
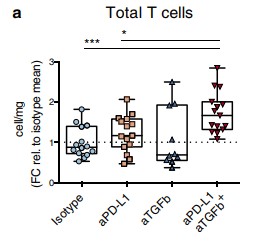
또한, EMT6 mouse mammary carcinoma model에서의 실험결과에서는 anti-TGFβ와 anti-PD-L1 병용 투여군이 anti-PD-L1 단독 투여군보다 높은 CR 비율을 가짐을 확인했다. (Figure 6)
Figure 6. Anti-PD-L1과 TGFβ 단독 및 병용 투여 종양 감소 효과 비교
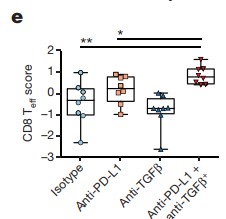
Anti-PD-L1과 anti-TGFβ 투여군에서 Infiltrating T cells은 유의하게 증가했으며 (CD8 Teff score), RNA-sequencing data에서는 CD8+Teff signature 증가를 보여줬다. (Figure 7)
Figure 7. Anti-PD-L1과 TGFβ 단독 투여군 T-cell Infiltration 비교
두 논문 모두 높은 종양미세환경(TME)에서 높은 TGFβ 발현이 T-cell exclusion과 연관이 되어있음을 시사한다. 즉, TGFβ 억제제와 PD-L1 병용 투여는, 기존 면역관문억제제에 낮은 반응률을 보이는 환자를 치료하는 새로운 전략이 될 수 있다 말한다.
“Mr. Gorvachev, Tear down this wall!” 1987년 6월 12일, 로널드 레이건 전 미국 대통령이 독일 베를린의 브란덴부르크 문 앞에서 외친 말이다. 그리고 2년 뒤, 베를린 장벽은 무너졌다. 이번 네이처 Highlight의 제목이 바로 Tear down this wall 이다. TGFβ inhibition은 Immune cell과 암세포의 상봉에 도움을 주는 연구 결과에 대하여 다뤘다. 많은 연구원들이 TGFβ inhibitor 뿐만 아니라, Angiogenesis, Cancer associated fibroblast infiltration, Immune suppression, Extracellular matrix degradation, Chronic inflammation 등 여러 공략을 통해 종양미세환경을 무너트리고자 한다. 베를린 장벽이 무너지고 냉전체계가 사라졌듯, TME 장벽이 무너지면 면역관문억제제가 작용하지 않는 Cold Tumor 도 사라 질 것으로 기대된다.

로널드 레이건 대통령 브란덴부르크 연설 장면
출처: (Ronald Reagan Presidential Library, ID C41244-9)
Reference
1. Harjes U. Immunotherapy: Tear down this wall. Nature Reviews Cancer 18, 205 (2018)
2. Jacob Pileth and Edwin Elmhirst, PD-1 / PD-L1 Combination Therapies. Evaluate, 3-5 (2017)
3. Tauriello, D. V. F. et al. TGFβ drives immune evasion in genetically reconstituted colon cancer metastasis. Nature 554, 538–543 (2018)
4. Mariathasan, S., Turley, S. J., Nickels, D. et al. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature 554, 544–548 (2018)
이전
2018.03.27
다음
2018.05.28