유럽종양학회(ESMO) 2022 주요 발표
국가신약개발사업단 기획운영팀 곽서연 선임연구원
세계 3대 종양학회 중 하나로
꼽히는 유럽종양학회, ESMO(European Society for Medical Oncology) 2022 연례학술대회가
지난 9월 9일부터 13일까지
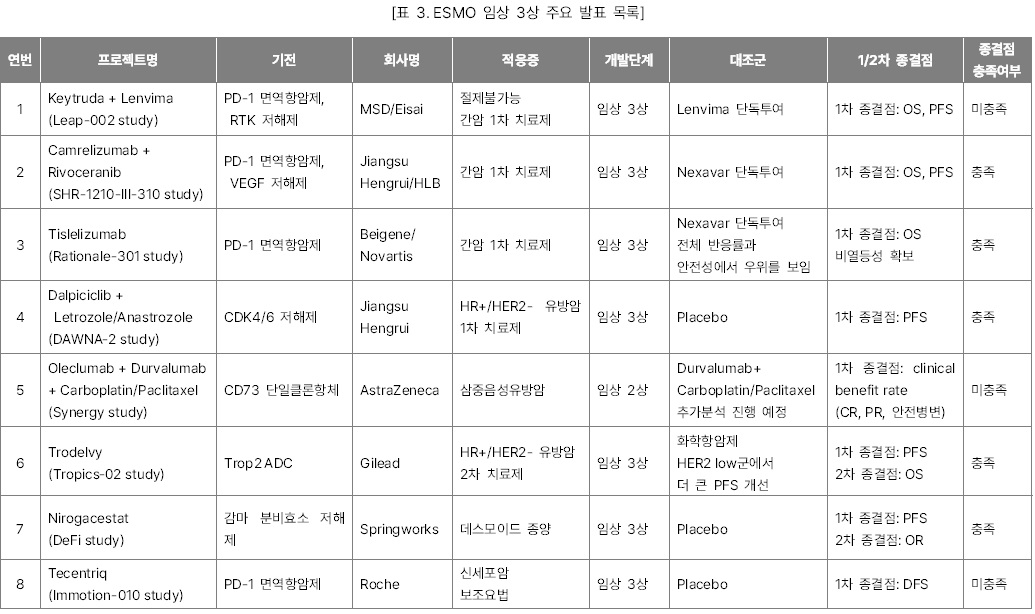
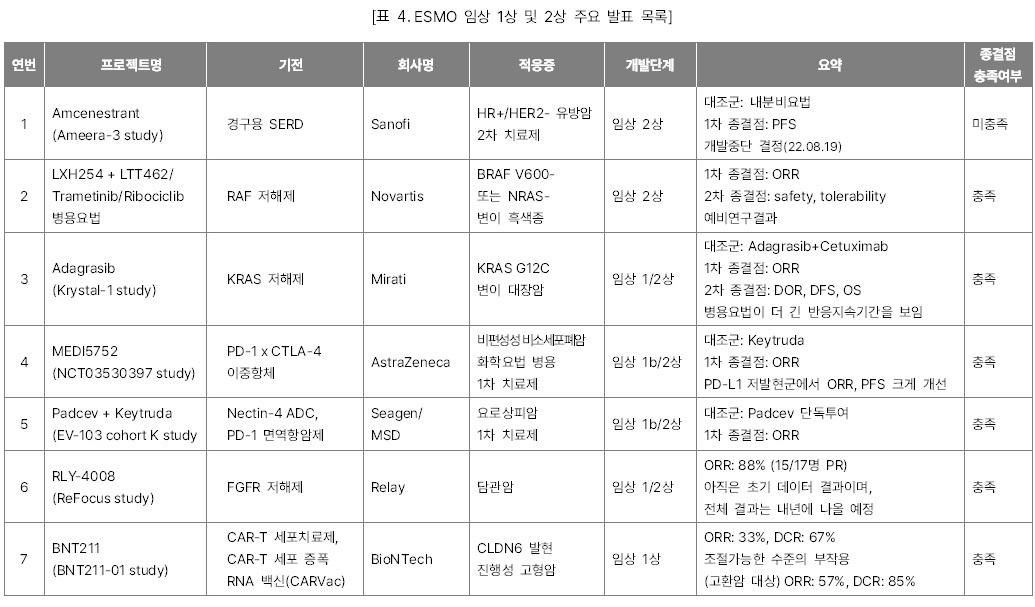
개최되었다. 올해 학술대회에서 소개된 수천 개의 최신 항암제 연구들 중 글로벌 제약·바이오 시장조사기관 Evaluate Vantage이 선택한 15개의 주요 발표 목록을 소개한다. 올해도 단연 큰 관심을 끈 것은 간암과 유방암 주축의 고형암 1차
치료제 임상시험 결과들이었다. 그 중 주목할 만한 결과들은 아래와 같다.
l
Keytruda + Lenvima 병용요법과 Camrelizumab + Rivoceranib 병용요법의 간암 1차
치료제 임상 3상 결과
l
HER2 저발현 유방암에서 유의미한 OS결과를
내며 Enhertu와 경쟁하게 된 Trodelvy의 임상
3상 결과
l 데스모이드 종양 1차 치료제로 자리 잡을 가능성이 높아진 Nirogacestat의 임상
3상 결과
l FGFR2를 표적하는 저해제로 기존의
FGFR 억제제의 일반적인 부작용 비율을 낮춘 Relay의
RLY-4008 임상 1상 결과
l 고형암을 대상으로 한 BioNTech의 CAR-T 세포 증식 RNA 백신과 CAR-T 세포치료제 병용요법의 임상 1상 중간 결과
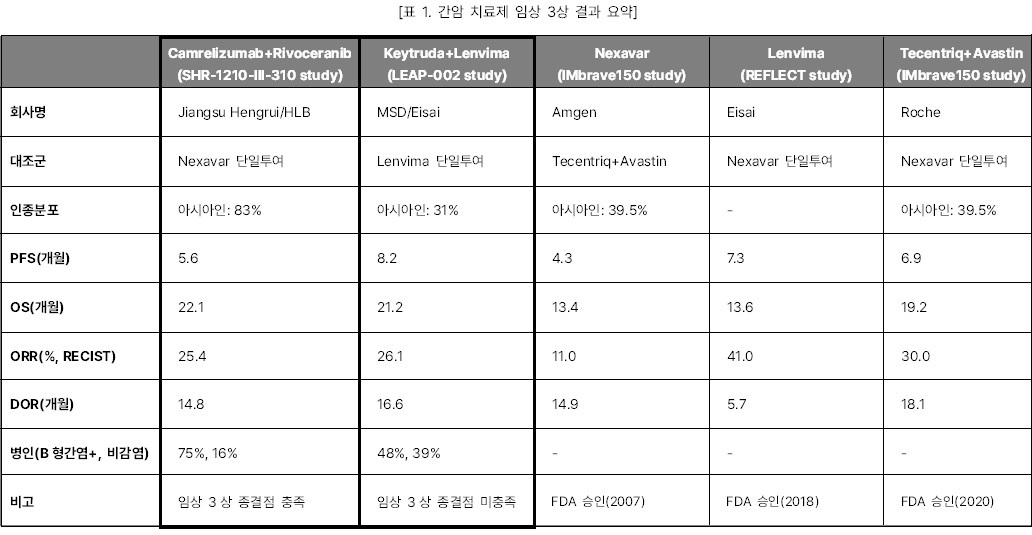
Camrelizumab+Rivoceranib 병용요법과
Keytruda+Lenvima 병용요법 간암 임상 3상
Camrelizumab+Rivoceranib 병용요법(Rivoceranib 병용요법)과 Keytruda+Lenvima 병용요법(Lenvima병용요법) 임상3상들이 PD-1 면역관문억제제와 TKI 약물의 병용요법라는 동일한 접근법과 적응증에도 엇갈린 임상결과가 나와 임상디자인의 중요성에 관한 다양한 논점을 낳았다.
먼저, 항서제약의 Rivoceranib 병용요법은 Nexavar를 대조군으로 설정한 반면, MSD의 Lenvima병용요법은 Lenvima를 대조군으로 비교하였다. Nexavar는 2007년에 간암치료제로 FDA 승인을 받은 후, 간암 치료제 임상 3상을 진행한 Lenvima(2018년 FDA 승인)과 Tecentriq+Avastin 병용요법(2020년 FDA 승인)의 대조군으로 사용되었다. IMbrave150 study에서 보인 Nexavar의 무진행생존기간(PFS)은 4.3개월로 REFLECT study에서 보인 Lenvima의 PFS보다 60%가량 짧다. 서로 다른 임상 시험의 결과를 직접적으로 비교하기는 어렵지만, 상대적으로 Rivoceranib 병용요법의 대조군이었던 Nexavar의 허들이 Lenvima보다 더 낮았다는 의미이다. UCSF 대학의 Robin Katie Kelley 교수는 두 병용요법과 Tecentriq+Avastin 병용요법 임상3상의 효능 결과를 비교 발표하며 “두 병용투여 임상시험 효능결과는 비슷했음에도 대조군 선택의 차이로 한쪽의 실패, 다른 한쪽은 성공으로 최종결과가 엇갈렸다”고 말했다.
두 임상시험은 모집된 환자의
병인과 인종분포에서도 차이를 보였다. Rivoceranib 병용요법은 참여자의 75%가 B형간염 양성(HBV+) 였던
반면 Lenvima병용요법 에서는 48%에 그쳤다. 간암 임상 메타분석에 따르면 HBV+군은 치료 후 전체생존기간(OS) 개선 효과가 컸지만 비감염군 환자는 그 효과가 미미했다. 실제
Lenvima 병용요법의 하위분석에서도 HBV+군은OS 개선 효과가 있었던 반면 비감염군에서는 OS 개선이 보이지 않았다. Rivoceranib 병용요법에서 아시아인 분포는 83%였던 반면 Lenvima병용요법의 아시아인 분포는 31%으로 두 병용요법 사이에
인종분포는 확연히 달랐다. 기존 간암 치료제 임상 결과에 따르면 인종분포의 차이는 임상결과에도 영향을
주는 것으로 보인다. Keytruda 간암 2차 치료제 임상
3상인 KEYNOTE-240와 KEYNOTE-394의 경우 각각 아시아인의 비율이 24%와 100%로 구성되었다. 아시아인 비율이 24%인 KEYNOTE-240는 유의한 개선이 없었으나 KEYNOTE-394는 1차 종결점인 OS의 개선을 보였다. 또한 IMbrave150
임상3상 내 중국인 환자를 대상으로 한 코호트 분석에서도 중국인 환자들의 OS는 전체 환자 평균보다 5개월 길어진 24개월로 나타나며 아시아인들이 더 좋은 효능을 보였다. B형감염은
서구인들에 비해 아시아인들에게 흔한 질환으로 알려져 있어 B형감염여부와 인종의 상관관계가 간암 치료제의
효과에 어떤 영향을 미치는지는 더 확인이 필요하다.
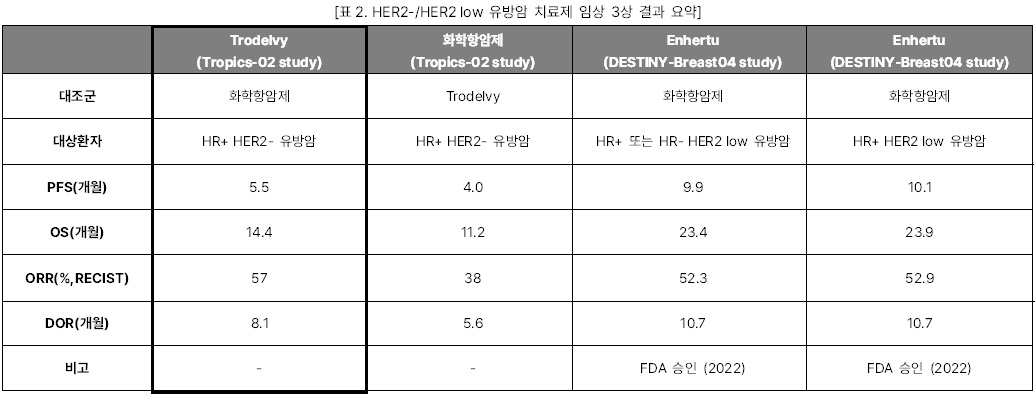
Trodelvy HR+ HER2- 유방암 임상 3상
이번 ESMO 2022에서 Gilead는 TROP2
ADC인 Trodelvy의 OS결과를 발표하며
ASCO 2022에서의 분위기를 반전시켰다. ASCO 2022에서
Gilead가 발표한 Tropics-02 study의 PFS 결과에 의하면, Trodelvy는 기존의 화학항암제를 사용한
대조군 대비 무진행생존기간(PFS)가 1.5개월 늘어나며
환자가 사망할 위험을 34% 낮추었다. 하지만 이것이 임상적으로
의미 있는 데이터인지에 대한 비판을 받았고, 같이 발표한 OS 중간분석에서도
대조군과 통계적 차이가 없음을 보여 향후 시장성에 대해 큰 의문을 남겼다. 하지만 이번 ESMO에서 발표한 OS최종분석결과에서 Trodelvy는 대조군 대비 환자의 사망위험을 21% 낮춘 OS, 개선된 객관적반응률(ORR), 반응지속기간(DOR) 결과를 통해 임상적으로 유의미함을 보여주었다.
관건은 Trodelvy의 타겟층이다. 지난 8월
최초의 HER2 low 유방암 치료제로 FDA 승인을 받은
Enhertu 타겟층과 Trodelvy 타겟층의 3분의 2가 겹치기 때문이다. Trodelvy의
타겟층인HER2-로 진단되는 HER2▲IHC1+,
▲IHC2+/ISH-
,▲IHC0
환자들이다. 이 중 미발현군 IHC0을 제외한 나머지 환자들이 Enhertu가 이번에 승인을 받은 타겟층인 HER2 low로 분류된다. 임상 결과를 직접 비교하기는 어렵지만 지난 ASCO에서 발표된 Enhertu의 DESTINY-Breast 04 study 결과를 보면, Enhertu가 월등히 좋은 PFS와 OS결과를 보이며 경쟁우위에 있다. 따라서 FDA 시판허가를 받는다면 Trodelvy는 HER2 low에 포함되지 않는 HER2 미발현군을 대상으로 포지셔닝을
할 것으로 보인다.
더 나아가 TROP2 발현과 임상적 이점 사이의 상관관계에 대한 추가분석도 필요하다. TROP2는
유방암 환자에게서 서브타입과 관계없이 80% 수준으로 발현하며 발현이 높을수록 예후가 좋지 않은 경향이
있는데, TROP2 바이오마커와 임상적 이점의 연관성에 대한 연구가 요구된다. 현재 Gilead는 Trodelvy를
HR+ HER2- 유방암 치료제로 FDA에 서류를 제출한
상태이다.
<문의>
국가신약개발사업단
기획운영팀 곽서연 선임연구원 (seokwak@kddf.org)
Reference
ESMO 2022 preview – front-line
liver cancer showdown, Evaluate Vantage
ESMO 2022 https://www.esmo.org/
이전
다음