이기호 SK바이오팜(주) 신약개발연구소장
[중추신경계(CNS) 질환 시장]
통계자료에 의하면 CNS 질환 치료제의 글로벌 시장은 2014년 현재 약 8백억불의 규모로 이는 전세계 의약품 시장의 약 15%를 차지하고, 심혈관질환 치료제와 항암제 시장을 뒤이은 거대 시장으로 알려져 있다. 또한 향후 사회변화에 따른 불안, 우울증, 조현병 환자의 증가와 인구노령화에 따른 치매환자의 증가로 CNS 치료제 시장 성장은 지속될 전망이다. 이러한 치료제 수요를 반영하듯이 2013년 통계자료에 의하면 미국에서만 390건의 신경계 질환 관련 약물, 119건의 정신질환계 약물의 임상시험이 진행 중이고 그 중 50%이상이 새로운 화합물 구조와 작용기전을 가지는 혁신약물로 알려져 있다.
CNS 시장 예측 보고서에 따르면 정신질환분야의 블록버스터 약물들의 특허가 조만간 만료되고, 그들의 Generic 약물들이 출현함에 따라 시장성장은 당분간 다소 정체될 것으로 전망하고 있으며, 여러 제약회사들은 이러한 상황을 극복하기 위하여 특허연장의 방법으로 약물의 새로운 적응증을 찾는 Drug repositioning 연구도 활발하게 진행하고 있다.
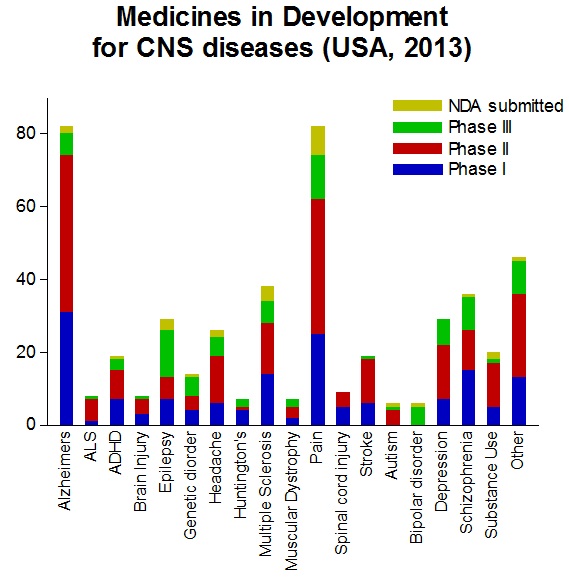
그림 1. 2013년 미국에서 진행되고 있는 CNS 임상시험 (출처: Medicines in Development, Pharma 2013, 2014 Report)
[CNS 질환분야의 R&D]
이러한 시장상황과는 별개로 우울증과 같은 정신질환 분야의 대규모 임상 실패나 단 0.4%에 불과한 지난 10년간의 알츠하이머병에 대한 낮은 임상시험 성공률과 같은 CNS분야의 R&D 비용부담 증가현상은 지난 몇 년간 대형 제약회사들이 CNS R&D 연구에 대한 투자를 철수하게 하는 요인이 되고 있다. 하지만 GSK, Sanofi 등의 연이은 CNS R&D 철수에도 불구하고 Roche와 같은 대형제약사들이 여전히 혁신적 연구를 지속적으로 주도하고 있으며, Lundbeck, Biogen Idec, UCB 등의 CNS 질환전문 제약회사가 신약개발 및 임상시험에 대한 투자를 계속하고 있다.
많은 제약회사의 개발자들이 다른 질환들보다 CNS질환의 신약개발이 어렵다고 느끼는 이유는 전임상 기간 동안 동물을 이용한 질환모델에서의 약효 확인에도 불구하고 이후 사람을 대상으로 한 임상시험에서 약효 부족과 부작용으로 실패하는 경우가 많은 것이 원인이다. 이는 CNS가 기능적으로 매우 복잡하여 그에 대한 이해가 아직 부족하고 사람과 동물간 차이를 양방향으로 Translation하기 어렵기 때문인데 CNS 약물 개발의 성공률을 높이기 위해서는 정상적 및 병적 상태의 CNS에 대한 전반적인 생리, 병리 및 뇌의 복합적인 기능의 이해가 필요하다.
따라서 성공적인 신약 개발을 위해서는 매우 다양한 in vitro/in vivo 약효 및 부작용 평가 체계의 확립이 필수적이고, 전임상 단계부터 상업적 가능성, 기술 가능성, 개발 용이성 등 여러 가지 사항들을 고려해야 하는데 특히 CNS 분야의 약물 개발 시 주의할 사항은 다음과 같다.
첫째, 약물이 CNS에 최대한 많이 노출되도록 설계하여 약효는 최대화 하고 동시에 부작용은 최소화하여야 한다.
CNS 약물의 임상적 성공을 위해서는 우선적으로 약물이 혈관-뇌 장벽(Blood-brain barrier)를 넘어 뇌의 특정 부위로 충분히 노출되게끔 하여 최대한의 Target 수용체나 단백질과의 결합을 통해 약리 활성을 나타낼 수 있도록 유도하여야 한다.
뇌로 잘 이행하는 약물이 되기 위해서 특정 범위의 물리화학적 성질을 가져야 한다는 것은 매우 잘 알려져 있는 사실이고 실제로 글로벌 제약회사에서는 이러한 룰을 참고하여 약물개발 단계에서 활용한다. 그러나 이러한 조건을 만족하며 용해도가 우수한 구조의 약물을 개발하기 위하여 개발단계의 모든 약물을 대상으로 동물 실험 결과를 확인하기에는 현실적으로 어려움이 따르기에, 개발 단계부터 전임상 후보 선정까지 Predictive ADME등의 다양한 in silico 기법을 활용하는 것이 바람직하다.
또한 임상시험에서 부작용이 적으면서도 약효를 보이기에 충분한 최적 용량을 선정하기 위하여 Target 수용체에 대한 점유율을 평가하는 Brain imaging 등의 다양한 Biomarker를 활용하는 기술을 고려해야 하며, 특히 혁신적 신규 작용기전을 가지는 약물일수록 이러한 기술을 전임상 단계부터 활용하여 약물의 brain 노출 정도와 약효간의 상관관계를 파악하는 것이 최적용량 설정에 도움이 된다.
한편 뇌로의 이행율이 낮은 약물의 경우 상대적으로 시스템 노출 농도가 높아 약물에 의한 간 독성 등의 부작용이 발생할 수 있으므로 주의하여야 한다. 또한 CNS 약물의 경우 보통 염기성 아민 구조를 가지는 화합물이 용해도가 우수하고 뇌로 잘 이행하는 장점을 가지게 되지만, 구조적 특징으로 인해 hERG channel 저해 등 심혈관 부작용이 같이 발생하는 경우가 있으므로 개발 단계부터 적극적으로 독성관련 시험의 결과를 확보하여 위험요소를 줄여나가야 한다.
둘째, CNS 특이적 약리 효과와 안전성/독성을 고려하여야 한다.
많은 수의 CNS 질환들은 우울/불안증 등과 같은 정서장애, 수면장애, 통증, 인지 장애와 같은 다양한 질환이 동반 질환으로 나타나기 때문에 이를 함께 치료하는 것이 중요하며 약물 자체가 이러한 부작용을 나타낼 경우에는 당연히 시장에서의 경쟁력이 떨어지게 된다. 따라서 개발 단계에서부터 약물의 약효뿐만 아니라 안전성을 확인할 수 있는 여러 시험을 수행하는 것이 성공 가능성을 높이는 방법이다.
ICH의 안전성 평가 가이드라인 (http://www.ich.org/products/guidelines/safety/article/safety-guidelines.html ) 에는 운동량, 행동변화, 협조성, 감각/운동반사반응, 체온, FOB (Functional Observation Battery, 기능관찰종합평가) 시험 등이 전임상 단계의 필수 안전성 약리시험으로 제시되고 있으며, 개발하고자 하는 약물의 CNS에서의 부작용을 평가하도록 안내하고 있다. 또한 이 시험들을 기본으로 하되 개발하려는 질환의 특성과 경쟁약물의 부작용 수준, 전임상 후보물질의 기전을 고려하여 행동약리, 학습 및 기억능력, 특이적 수용체 결합, 신경화학, 시각, 청각 및 전기생리학적 검사 등 추가시험 (표1.)을 보완, 설계하여 약물의 약리학적 영향을 충분히 평가하는 것이 바람직하다.
표1. CNS 행동약리 평가를 위한 동물모델 사례
Human/
Animals |
Activation/ agitation |
Cognitive disturbance |
Mood
destabilizing |
Mood
stabilizing |
| Forced Swim Test |
|
|
V |
V |
| Light/Dark Box |
V |
|
V |
|
| Dominant-submissive behavior |
V |
|
V |
V |
| Tail Suspension |
|
|
V |
V |
| Chlordiazepoxide/ amphetamine |
V |
|
V |
V |
| Morris Water Maze |
|
V |
|
|
| Novel Object Recognition |
|
V |
|
|
| Long Term Potentiation |
|
V |
|
|
| Passive Avoidance |
|
V |
V |
|
| Elevated Plus Maze |
V |
V |
V |
|
| Radial and T-maze |
|
V |
V |
|
ICH에서 제시하고 있는 기본적인 안전성시험에 추가하여 한국 식약처에서는 2008년에, 미국 FDA에서는 2010년에 약물의존성평가 시험에 대한 지침을 발표하였다. CNS에 작용하는 의약품의 의존성과 관련한 부작용은 최근 전 사회적 문제로 대두되고 있는데 이 지침들에 따르면 약물의 의존성이 의심되는 약물은 전임상 개발 단계부터 신체적 의존성(Drug Dependence), 약물 식별(Drug Discrimination), 자가 투여(Self-Administration), 조건장소선호도(Conditioned Place Preference) 시험법 등을 통해 안정성 정도를 주의 깊게 평가하여야 한다. 또한 미국 FDA에서는 2012년부터 모든 CNS 약물의 임상 1상 실험에서 자살 충동/행동에 대한 평가를 의무화하고 있으므로 약물 개발단계에서 관련 시험법의 수행이 필요하다.
또한 CNS 약물의 경우 보통 다양한 Target과 동시다발적으로 작용을 함으로써 약물의 약리 효과를 나타내게 된다. 이러한 On-target, Off-target 선택성에 따라 부가적인 약효나 관련 부작용이 나타나기도 하므로 약물 개발단계에서 약물이 in vitro 수준에서 어느 수용체에 어느 강도로 작용하는지를 미리 살펴 독성을 예측하고 대비하는 것이 필요하다. 예를 들어 과거의 우울증, 조현병 치료제들 중에 5-HT2C, H1, M3 수용체의 선택성이 작을 경우 비만이나 진정작용 등의 부작용이 함께 나타나는 문제가 있었고 현재는 이를 개선한 약물들이 시장에서 주목 받고 있다.
[성공적인 CNS 신약 개발을 위하여]
이와 같이 CNS 약물을 개발하기 위하여 약물의 약리 효과뿐만 아니라 약물개발 초기 단계에서부터 안전성에 대한 고려도 같이 이루어져야 한다. 그 동안 국내의 경우 주로 항암/대사/당뇨 질환 치료제 개발에 제약회사의 신약개발 활동이 집중되어 있었다. CNS 질환의 사회적 중요성에도 불구하고 협소한 국내 시장규모와 임상개발 비용 부담 때문에 CNS 질환의 신약 개발 활동이 거의 없었고 앞으로도 당분간은 신약개발 보다는 CNS Generic 개발 경쟁이 치열할 것으로 전망되고 있다.
이처럼 CNS 분야뿐만 아니라 미충족 의료 수요가 높은 질환이나 희귀/난치성 질환 등에 대한 국내 신약개발을 장려하기 위하여 정부차원에서 노력도 필요하다. 예를 들어 미국의 국립보건원(NIH)의 주관 하에 진행중인 알츠하이머 예방계획(Alzheimer`s Prevention Initiative) 과 같이 정부기관이 해당 질환의 획기적 치료제를 찾는 R&D 기능을 주도적으로 수행함으로써 민간부문의 R&D 부담을 줄여 주는 방향을 고려할 수도 있을 것이다.
<참고자료>
Pharmaceutical Industry - 2010 GBI Research
Medicines in Development, Pharma 2013, 2014 Report
NATURE REVIEWS | DRUG DISCOVERY VOLUME 6 | JULY 2007 | 521
NATURE REVIEWS | DRUG DISCOVERY VOLUME 13 | JUNE 2014 | 421
Drug Discovery Today Volume 17, Numbers 9-10, May 2012, 419-424
Drug Discovery Today Volume 19, Numbers 4, April 2014, 489–495
Drug Discovery Today Volume 17, Numbers 19/20, October 2012, 1068-1078
Bioorganic & Medicinal Chemistry Letters 20 (2010) 7312–7316
European Journal of Pharmacology 450 (2002) 37– 41
FDA's 14 August 2012 draft guidance, Suicidal Ideation and Behavior: Prospective Assessment of Occurrence in Clinical Trials,
의약품 독성시험 흐름도(해설서) 2012년 12월 식품의약품안전청
의약품등의 의존성 평가지침 2008년 12월 식품의약품안전청
안전성약리시험길라잡이(Ⅱ) 중추신경계 안전성 2012년 3월 식품의약품안전평가원
