중개의학 시스템(1/2)
임상연구에 대하여
최 승은
M.D., Ph.D
1. 시스템이란 무엇인가?
1820년대, 프랑스 물리학자인 Nicolas Léonard Sadi Carnot에 의해서 시스템의 과학적 개념이 도입되었다[1]. 시스템 개념 도입의 이유는 자연과학의 수행에서, “Integration, 통합”의 중요성을 공유하기 위한 것이다. 세부적인 요소들이 존재하는데, 시스템은 (1)구성원의 공통된 목표, (2)유기적인 상호 관계 (3)개방적인 관계 (4)전체적인 관계 인 4가지 요소를 가진다. 이런 요소들은 프로그램으로 구체화되거나, 지속성과 발전성(sustainability and development)이 우선순위인 경우, 조직이 만들어져서 실행된다.
2. 임상연구에서 시스템의 발달
임상연구는 고대 바이블에서 등장한 만큼 역사가 매우 오래되었다[2,3,4]. 의학의 발전과 임상연구의 역사는 같이 진행되었으며, 많은 시행착오가 있어왔다. 세계 2차 대전 이전에도 임상연구에 참여하는 피험자(Subject)들을 위한 “인권선언”은 존재해왔으나, 세계 2차 대전 중에 수행된 수많은 “비인륜적인” 임상시험의 결과로 인해, 많은 전문가들에 의해서 실천(practice)측면이 강화된 인권선언들이 등장했다. 그 대표적인 예들이 1947년 뉴렌버그 선언, 1966년 헬싱키선언이다[2.3]. 주요내용은 “피험자의 자발적 참여”를 보장하는 것이었다. 임상연구는 피험자를 보호하기 위한 시스템으로 윤리시스템과 규제시스템이 같이 발달해왔으며, 이것이 임상연구가 “규제과학(Regulatory Science)”이라는 별칭을 얻은 이유이다. 투자측면에서 바라보자. 임상연구에 대한 선진국의 데이터와 우리나라 데이터를 같이 분석하여 추정하면, 볼륨적인 측면에서는 기초연구의 100분의 1도 안되지만[5.6], 투자측면은 미국의 경우, 헬스 케어 투자의 50%정도가 임상시험 비용이다[그림1, 그림2]
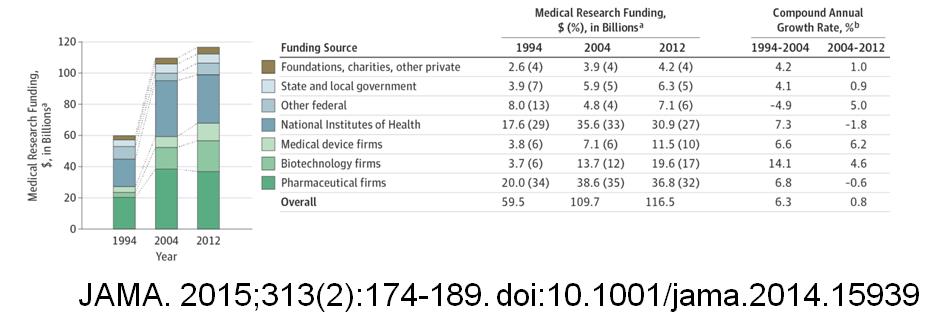
[그림1]
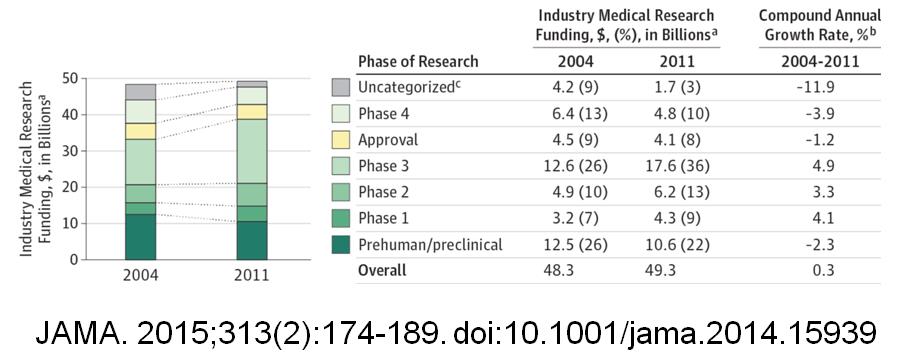
[그림2]
많은 투자를 요구하는 연구이기에 보다 효율적인 투자 시스템이 필요하다. 임상연구를 “산업(Industrialization”으로 바라보면 안 되는 이유가 여기에 있다. 산업은 “가장 효율적인 투자와 높은 수익”이라는 기본 개념을 가지는 반면에, 임상연구는” 높은 투자에 의한 수익마련이 아닌, 높은 투자에 의한 객관적 근거(Evidence)마련(Preparation)” 이라는 접근이기 때문이다. Site(임상용어이며, 임상시험이 수행되는 병원이나 연구기관을 지칭함) 측면에서도 같은 논리이다. 임상시험을 수행하기 위해서는 인건비, 간접비, 직접비등의 높은 투자가 필요하기에, 이를 기업이나 정부로부터 투자를 받아서 수행하게 되고 그 결과를 내는 것이다. 이에 임상시험은 site측면에서는 가치(Value)또는 근거(evidence)를 결과로 도출하는 것이며 수익이 나는 구조가 되지 못한다. 그렇다면 왜 기업이 임상연구에 많은 투자를 해왔는지를 보면, 임상연구가 “산업”이기 때문이 아니고 상업화를 가기 위한 여정에서 외부 관계자들, (연구자, 정부관계자 그 외.)의 요구인 윤리적, 규제적 측면을 충족시켜 주기 위한 필수적인 과정이었기 때문이다. 그렇기에 기업에서 임상연구는 근본적으로 Research and Development 개념이며, 이를 위한 규제, 윤리 그리고 투자시스템이 “유기적”으로 발달해왔다.
1. 임상연구/시험의 정의 및 외국과 우리나라 임상 수행
A. 정의; 임상연구(Clinical study)와 임상시험(Clinical trial)의 정의는 실제 현장에서는 매우 혼재되어 사용되고 있으나, 각각의 정의는 존재한다[7]. 임상시험은 임상연구수행과정에서 시간이나 공간, 임상수행 요건 등에 인위적인 조작이 존재한다. 이를 “중재(interventional)” 라고 표현하며, “시도, 시험(trial)”이라고 표현하는 이유이다. 일반적으로 각 나라 규제주체의 시판 허가를 얻기까지의 임상연구가 이에 속한다. 그러나 시판 허가를 승인 받은 후에도 유효성(Efficacy)과 안정성(Safety)에 대한 근거를 마련 해야 하는 경우에, 임상시험디자인을 통해서 연구를 수행한다. 이런 인위적인 조작을 극복하기 위해서 임상시험의 단계가 올라갈수록 보다 자연적인 측면을 더욱 강조하게 된다. 임상연구(Clinical study)는 보다 넓은 의미이며, “자연스러움(in nature)”을 더 강조하는 임상디자인인 경우, 임상연구라고 지칭한다. 보통 시판허가 이후에 많이 수행되며, 여기에는 관찰형(Observation), 시판후조사(Postmarketting surveillance)등이 포함된다. 임상시험과 임상연구의 정의에 따라 수행절차(operation process)가 많이 달라진다. 한 예를 들면, 임상시험은 보통 시험 약을 후원자가 제공하지만, 임상연구 중, 관찰연구에서는 in nature측면에서 제공하지 않는 경우가 많다. 특히 고가의 임상시험 약인 경우나, 임상시험기구인경우, site에서 후원자와 연구자간에 많은 논의가 오고 가게 된다. 임상시험의 종류는 매우 다양해졌으며, 이는 cost를 saving 하기 위해서, 그리고 윤리적인 차원에서 발달해왔다[8, 9, 10, 11][그림3]
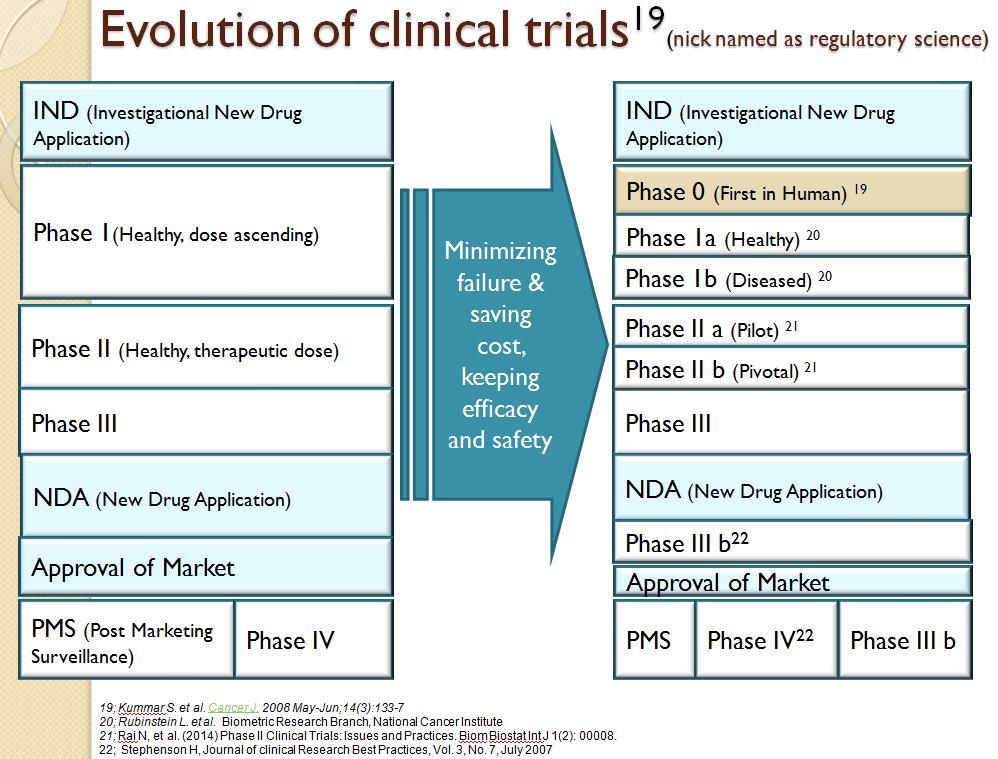
[그림 3]
B. 외국의 시판허가 전 임상시험 현황: 시판허가 전 임상시험은 임상 3상까지를 의미한다.
i. 윤리측면; 임상윤리의 기본은 국가간 차이가 없다 윤리의 핵심은 프로토콜의 제작과 각 사이트에서의 운영에 있으며, 1966년, 자발적인 전문가들의 선언인, ICH(International Conference on Harmonization)published GCP(Good Clinical Practice)에 따른 운영절차가 윤리의 실행적인 측면이다. 이런 선언들은 프로토콜에 운영절차로 제작되며, 이는 연구자들이 기본적으로 수행하는 절차가 된다. 즉, 윤리를 실행하는 주체는 연구자인 것이다. 최근에, 다 국가 임상시험 형태와 관련하여 “윤리성”측면에 대한 문제가 제기되고 있다 [12]. 미국 FDA의 승인을 받을 임상 3 상의 경우, 다 국가로 진행하고자 할 때, emerging country에서 수행되는 임상시험절차(operation process)가 과연 윤리적이며, 이 데이터를 미국시장에 응용하는 것이 맞느냐는 미국 내 연구자들의 의견이다.
ii. 규제측면; 미국이나 유럽의 임상시험은 ICH와 연결된 GCP code가 존재하며[13], 이에 monitoring process가 정부에 의해, 연구관련, 각 임상이 이루어지는 site monitoring등이 정기적으로 이루어진다. 미국 FDA는 약 9000여명의 직원이 존재하며, 이중에 1000 여 명 정도가 각 지역 모니터링에 종사하고 있다. 그리고 이런 규제에 대해 각 연구자에게 각 사이트에 존재하는 교육기관을 통해서 주기적으로 교육과 훈련을 통하여 전달된다.
iii. 투자측면; 미국이나 유럽에서는, 아직은 기업으로부터의 투자가 50 %를 차지하지만, 정부의 투자가 점점 활발해지고 있으며, 환자들에 의한 투자도 발생하고 있다. 희귀질환에 대해서, 연구자들에 의한 drug repositioning이 활발해지고 있으며, 기업도 희귀질환 에대한 투자를 멈추지 않고 있다. 희귀질환도, 마켓측면에서 의미가 있기 때문이다. 바이오마커 발굴은 거의 모든 임상시험에서 같이 수행되며, 이는 여러가지 이노베이션에 응용된다. 투자와 개발의 선 순환을 위한 끊임없는 공개토론과 논의가 정부와 아카데미, 기업의 중재로 이루어지고 있다.
C. 외국의 시판허가 후 임상연구 현황; 임상 4 상은 개략적으로, 시판허가 후의 임상시험이다. 임상 4 상의 목적은 시판허가 전 임상연구보다 그 범위가 넓다. 승인 전 시험에서 시험하지 못한, Efficacy와 Safety를 목적으로 하는 경우가 고전적 목적이다. 시판허가 후 임상에는 연구자 주도 임상이 포함된다. 미국과 유럽은 연구자 주도 임상도 매우 활발하다. 특히 drug repositioning 차원에서 근래 효율적인 신약개발 방법 중의 하나로 자리잡고 있다.
i. 윤리측면; 시판허가 후 임상에도 시판허가 전 임상과 같이 어떤 목적을 가지는지, 유효성을 보는지, 안정성을 보는지 등에 따라 임상 1,2,3 상과 같은 시스템이 적용된다. 임상시험의 윤리의 key는 바로 프로토콜의 확립과 수행이다. 임상시험의 프로토콜 제작에는 연구자주도나 회사주도 관계없이, 모든 관계자들이 관여한다. 이미 승인이 떨어진 약물이기에 규제측면에서는 fast track이 존재할 수 있다. 그러나 현장에서의 임상연구는 똑같이 피험자가 참여하기에 모든 윤리행위는 시판허가 전 임상연구와 동일하다.
ii. 규제측면; ICH와 GCP code가 존재하며, 이에 monitoring process가 정부에 의해, 연구관련, 각 임상이 이루어지는 site monitoring등이 정기적으로 이루어진다. 의료기기는 그 종류가 신약쪽에 비교하여, 10 배 이상의 종류가 존재하기에 미국 FDA도 인프라가 부족하다. 이에 기업과 consortium을 통해 priority를 셋팅하고 있는 중이다[14]. 의료기기에서는 임상 4 상이 매우 중요하다. FDA 규제트랙에서 의료기기 시판허가를 위한 승인과정트랙이 달리 존재하고, 의료기기는 systemic effect보다는 국소적인 안정성등이 문제이기에 대부분의 허가전 임상에서 임상1, 2, 3상을 따로 구분하지 않는다. 이에 4상에서는 시판 후 안정성과 유효성이 지속적으로 요구되며, 이를 임상으로 통해서 검증하고자 한다. 2010년에 수행된 시판 후 임상을 통해서, 안정성의 문제가 대두되었고 이는 시장에 나온 의료기기의 리콜의 결과를 가져왔다[15].
iii. 투자측면; 시판 허가 후 임상에도 크게 두 가지 투자주체가 존재한다. 기업은 시판후 조사를 반드시 수행해야 하는 경우, 투자를 담당하며, 그 외의 임상 4 상이나, 연구자주도 임상의 경우 전략적인 투자를 수행한다. 미국정부는 2000년대 초반부터, 사회적 필요에 의해 다자간의 협의를 통한 consensus를 확립하면서 투자를 진행하거나 기업으로부터의 투자를 유도하고 있다. 2000년대초반부터, 미국은 NIH, 영국은 MRC등에서, 집중적으로 중개의학을 통하여 임상시험에 투자를 하고 있다[16, 17].
2. 임상시험과 중개의학
임상시험은 (1) 임상시험 단독만으로는 존재해서는 안 되는 과학이다. 좀더 폭넓은 “호기심”과 “의문”을 필수소양으로 가져가는 기초탐구와 비교하여, 윤리와 규제가 강하게 들어오는 시스템 안에서 이루어진다 (2) 임상시험은 기초탐구를 통한 “물질”이나 “새로운 치료방법”이라는 전제가 필요하다. (3) 임상시험은 명확한 ”사람에의 응용”이라는 목표가 존재한다. 임상시험이 끝나고, 승인을 받은 후에도 일련의 과학적 행위들이 발생하며, 새로운 치료방법이나 물질들의 존재유무를 지속적으로 검증해야 한다. 시판허가 후에도 일련의 과학적 활동을 통해서 허가 받은 물질의 withdrawal이 심각하게 고려되어지기도 한다[18]. 이러한 이유들로 임상시험은 중개의학/중개연구 라는 더 큰 틀 안에서 이루어져야 하는 의학이다.
[결어 및 논의]
지금까지 시스템이라는 측면에서 임상연구에 대해 언급했다. 임상연구는 현장에서 돌아가며, 현장이 곧 시스템적으로, 유기적으로 돌아가야 한다. 규제나 윤리가 문서상으로 작성이 되어도, 투자제도가 만들어져도, 그것이 현장까지 전달되고, 현장에서 올바로 수용되고 정착되지 않으면 그 임상데이터는 무의미하다. 이런 차원에서 몇 가지 앞으로 관계자들 사이에 논의되어지길 바라는 부분에 대해 언급해보겠다.
1. 시스템의 수직적 운영 측면- 물론 복잡한 임상연구의 틀은 각각의 질병영역에서 flexible하게 변형되고 그 질병영역의 특성에 맞추어 전략적으로 운영 되어질 수 있다. 전략적 운영에는 그 분야의 현장에 대한 전문성이 있어야 가능하다. 4 가지 기본요소의 시스템을 운영하는 성공은 바로 “목표”와 “전략”과 “현장”의 alignment, 유기적인 결합이다. 이러한 유기적인 결합을 위해서 구체적으로 어떤 실천을 해야 하는 것일까? 조직의 상위 개념인 목표가 현장에까지 왜곡 없이 도달되어 잘 운영되려면 어떤 부분이 보완되어야 할까? 이 부분은 저자가 감히 결론을 내릴 수 있는 부분이 아니다. 논의 대상으로 판단된다.
2. 윤리, 규제, 투자 시스템의 수평적 운영 측면- 윤리시스템과 규제 시스템 그리고 투자시스템에 따라 운영되는 것이 “현장”이다. 임상연구가 수행되는 현장은 의료 전문가들이 존재하는 병원이다. 현재 의료전문가들은 정말 많은 임상연구를 수행하고 있으며, 임상연구의 분포가 site별, 도시별 지역별 치우침이 심하다. 비교하여, 마켓에서 성공한 신약이나 치료방법은 많지 않다. 물론 아직 그 결론을 이야기하기 어려운 질병영역, 치료영역도 존재한다. (그 대표적인 영역으로 유전자치료제, 세포치료제등이 있다) 병원에서의 임상연구 운영은 어떤 인프라를 통해 어떻게 이루어져야 가장 효율적인 운영이 될 수 있는가, 임상시험의 목적이 과연 개별적인 인용지수인가 [그림4-1], 아니면 환자에의 성공적인 적용을 통한 마켓에서의 인정인가[그림4-2]에 대한 부분은 우리모두가 고민해야 할 부분이다[그림 4].
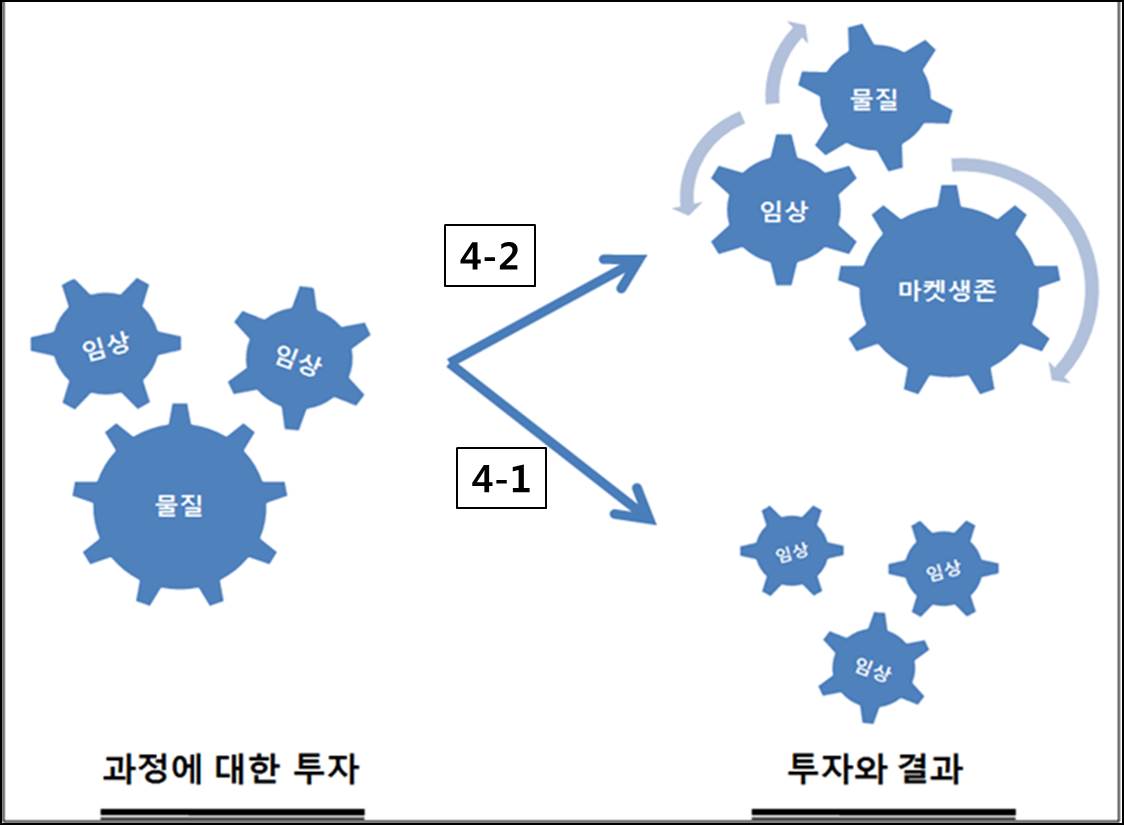
[그림 4]
승인 후 임상시스템 관련하여- 규제시스템과 투자시스템의 충돌이 여전히 존재한다. 바로 리베이트(rebate), 킥백(Kick-back)측면에 대한 규제시스템과 연구활동에 대한 투자시스템이다. 시판 후 조사(Post marketing Surveillance: PMS)를 과거에 연구자들에게 영업상의 이익의 돈을 지불하는 용도로 사용된 경우가 적발되어, 기업이나 연구자들이 최근에는 모두 이 부분의 연구를 꺼리는 경향들이 있는 경우를 발견한다. PMS는 이미 언급한 바와 같이, regulation에 의해 요구 되어지는 사후안정성, 사후 유효성을 검증하고자 하는 의과학적 연구이다. 승인 후 PMS를 충족하지 못하는 경우 그 나라에서의 판매승인이 취소되는 경우도 발생한다. 특히 질병환자수가 적은 경우에, 정해진 기간 동안, 사후임상연구에 들어오는 피험자 수를 충족하지 못하는 경우가 발생한다. 우리나라는 환자들의 분포가 대부분 큰 병원에 집중해있기에 큰 병원에서 시판 후 조사에 응하지 않을 경우, 그 오랜 기간 동안 개발해온 신약은 그 나라의 환자들이 경험할 기회를 잃어 버리게 된다. 기업은 마켓조사를 통해서 환자가 많은 나라를 마켓으로 지정하고 그 나라에서 약을 팔 여러 가지 regulation을 충족하고자 투자를 하는데, 그 나라의 규제시스템과 충돌하는 경우, 결국 환자들에게 그 손해가 돌아가게 된다. 그 외에 임상 4 상, 연구자주도임상등에도 아직은 임상1,2,3상에 비교하여, 3 가지 시스템이 유기적이지 않다. 투자시스템에 있어서 오류가 있음은 현장에서의 연구자들의 인프라투자에서 엿볼 수 있다. 연구자주도임상은 매우 활발히 일어나고 있으며, 투자를 받기 위해 연구자들은 대부분 개발사와 논의하며, 개발사에게서 투자를 받지 못하는 경우에는 투자시스템이 존재하고 있지 않다. 개발사는 임상투자에 있어 내부적인 전략이 존재하기에 연구자주도임상에 대한 투자인 경우, 내부의 논의 과정이 매우 길고 어려우며, 이에 연구자들은 최장 1년 여의 승인과정을 기다리다가 승인을 받지 못 하는 경우, 만들어둔 인프라 등의 유지로 많은 어려움이 따르게 된다. 승인 후 임상 중 특히, 연구자 주도인 경우, 투자를 받을 경로가 다양하지 못하다. 거의 대부분 기업투자이며, 이에 기업과 연구자가 원하는 end point가 다른 경우가 많이 발생한다. 2000년대 초반부터 나온 “Drug repositioning”은 연구자주도임상의 중요성을 다시 한번 일깨우게 한 부분이 있으며, 이에 미국은 최근에 연구자주도임상을 통하여, 현재 치료제가 확립되어있지 않은 Polycystic Kidney Disease에 대한 치료제를 탐색 중이다. Drug repositioning은 우리나라같이 많지 않은 보건재정을 고려할 때, 발굴 해야 하는 신약 및 적응증의 숙제를 가지고 있는 나라에 적합한 개념이다. 또한 무엇보다도 우리나라의사들의 지적 수준은 세계최고에 속한다고 본다. 기존의 시스템을 재활용하여 지적재산권을 획득하고, 개발시간을 줄이는 것은 개량신약 등의 개념과 같이 매우 적절한 방법이라고 보며, 이를 위한 투자시스템은 어떤 것이 적당할지를, 어떤 규제시스템이 적당한지, 의료현장전문가들은 자발적으로 어떤 윤리시스템을 도입해야 하는지, 관계자들의 논의를 기대해본다.
3. Device영역, 새로운 치료기법영역- 지면상 의료기기영역과 새로운 치료기법, 세포치료제등의 영역은 다루지 못했으나, 이 부분들도 역시 중개의학시스템의 4가지 요소에 준해서 개발될 경우, 충분한 globalization을 할 수 있을 것이라 확신한다.
[참고자료]
1. Alexander Backlund (2000). 'The definition of system'. In: Kybernetes Vol. 29 nr. 4, pp. 444–451
2. Bhatt A. Perspect Clin Res. 2010 Jan-Mar; 1(1): 6–10
3. Collier R., CMAJ : Canadian Medical Association Journal, 180(1), 23–24.
4. Jenkins J. et al. Seminars in Oncology Nursmg, Vol 7, No 4 (November), 1991: pp 228-234
5. Shin S., The current status and policyof early stage clinical trials in Korea, ClinEval., (2011) 39(2), 367-375
6. Moses H 3rd., et al: The anatomy of medical research: US and international comparisons. JAMA, 2015 Jan 13;313(2):174-89. doi: 10.1001/jama.2014.15939.
7. https://www.nichd.nih.gov/health/clinicalresearch/clinical-trials/Pages/about.aspx
8. Kummar S. et al. Cancer J. 2008 May-Jun;14(3):133-7
9. Rubinstein L. et al. Biometric Research Branch, National Cancer Institute
10. Rai N, et al. (2014) Phase II Clinical Trials: Issues and Practices. Biom Biostat Int J 1(2): 00008.
11. Stephenson H, Journal of clinical Research Best Practices, Vol. 3, No. 7, July 2007
12. Glickman WS et al. Ethical and Scientific Implications of the lobalization of Clinical Research. NEJM, med 360;8 nejm.org february 19, 2009 p816-823
13. http://www.fda.gov/ScienceResearch/SpecialTopics/RunningClinicalTrials/GuidancesInformationSheetsandNotices/ucm219488.htm
14. http://www.fda.gov/downloads/MedicalDevices/NewsEvents/WorkshopsConferences/UCM381514.pdf
15. https://en.wikipedia.org/wiki/2010_DePuy_Hip_Recall
16. http://www.ncats.nih.gov/ctsa
17. http://www.mrc.ac.uk/funding/science-areas/translation/
18. https://www.gov.uk/drug-safety-update/rosiglitazone-recommended-withdrawal-from-clinical-use