위암 표적치료제 개발을 위한 도전
고봉국 앱클론 신약연구소 부소장
위암은 세계적으로 암에 의한 사망원인 중 3위이며 발병율은 5위인 암으로, 특히 한국을 비롯한 중국, 일본, 동남 아시아 등의 동아시아 지역에서 이들 환자의 50%이상이 발병하고 있다 (GLOBOCAN 2012). 국가암등록통계에 따르면 2013년 국내에서 위암은 30,184건이 발병하여 전체 암 발생의 13.4%로 갑상선암에 이어 암빈도수 2위를 나타내고 있다. 이를 남녀 성별로 구분하면 남성 암중에는 1위, 여성 암중에는 4위를 보이고 있다.
최근 우리나라에 있어 위암의 조기검진 빈도와 선도적 수술 등으로 인한 위암 환자의 5년간 생존률은 70%에 육박하고 있다. 하지만 위암은 증상이 나타나지 않아 진행성 혹은 말기 상태에서 진단되는 경우가 많고 원격전이 위암 환자의 5년 생존율은 5.8%로 매우 낮다. 기존의 진행성 혹은 전이성 위암 환자에 대한 1차 치료제는 platinum과 fluoropyrimidine 기반의 두 세가지 약물을 병용하고 있으나 그 효과가 제한적이어서 새로운 개념의 위암 표적치료제의 개발이 요구되고 있다. 최근 HER2 표적치료제인 trastuzumab과 VEGFR2 표적치료제인 ramucirumab의 승인으로 위암에서도 표적치료제가 사용되기 시작하였으며, 이외의 다양한 표적체료제 및 면역치료제에 대한 임상이 진행되고 있다. 이러한 발전에도 불구하고 위암은 예후가 좋지 못한 암으로 새로운 치료요법의 개발이 필요하다.
1. HER2 표적치료제
HER2는 위암과 유방암 환자의 20-25%에서 과발현되는 단백질로 PIK3K/AKT와 MAPK 신호전달계를 통하여 암의 발병과 진행에 관여하는 것으로 알려져 있다. HER2를 표적하는 항체의약품인 trastuzumab은 이미 유방암에서는 1998년부터 사용되었으며, 2010년 ToGA trial를 바탕으로 위암 치료제로 승인됨에 따라 위암에서 표적치료제의 새로운 장을 열었다. ToGA trial은 24개국 122개의 기관에서 진행된 임상 3상 연구로, 594명의 위암 환자를 대상으로 기존 화학요법 대비 trastuzumab을 추가했을 때의 효능을 분석하였다. 연구 결과 trastuzumab의 병용치료는 생존기간 중간값(median overall survival)은 11.1개월에서 13.8개월로, 무진행 생존시간 중앙값(median progression free time)은 5.7개월에서 6.5개월로, 반응률(overall response rate)을 35%에서 47%로 다소 향상시켰다(1).
최근 HER2를 표적하며 유방암에서 승인된 pertuzumab, trastuzumab emtansine(T-DM1), lapatinib의 위암에서의 효능에 대한 임상도 진행되고 있다. 특히 pertuzumab은 trastuzumab과 병용투여 시 유방암에서 시너지 항암 활성을 보이는 항체의약품으로 동일 표적 단백질에 대한 항체 병용투여로 승인된 첫 번째 의약품이다. 이에 위암에서도 pertuzumab과 trastuzumab의 병용요법에 대한 임상 3상이 진행 중이다. Trastuzumab에 독소를 결합한 T-DM1은 유방암에서와 동일하게 trastuzumab 기반 치료에 반응하지 않는 HER2 양성 위암 환자를 대상으로 한 임상 3상이 진행 중이다. HER2와 EGFR을 동시에 표적하는 저분자화합물인 lapatinib은 1차 치료요법 임상인 LOGiC trial 및 2차 치료용법 임상인 TyTAN trial 모두에서 유의미한 효능을 보이지 않는다는 결과가 발표되었다. 따라서 유방암에서의 pertuzumab과 trastuzumab의 병용요법 시너지효과의 경우처럼 앞으로 위암에서도 HER2 표적 시너지 약물의 개발도 큰 기대를 해볼 수 있다.
표. 개발중인 위암 표적치료제 타깃
|
Class |
Target |
|
RTK |
EGFR, HER2, HER3, FGFR2, HGF/MET, IGF1R |
|
Signaling molecule |
PI3K, AKT, mTOR, JAK2 |
|
Anti-angiogenic |
VEGF/VEGFR2 |
|
Immune checkpoint |
PD-1/PD-L1, CTLA-4 |
2. VEGF/VEGFR2 표적치료제
신생혈관생성은 암 발생 및 진행에 중요한 과정이며 VEGF에 의한 VEGFR2 신호전달계가 대표적이다. 신생혈관생성 억제를 통한 암 치료의 가능성은 VEGF 억제제인 bevacizumab의 폐암, 난소암, 신장암, 뇌암에서의 승인으로 검증되었다. 하지만 bevacizumab은 위암에서 1차 치료요법 임상인 AVAGAST trial에서 생존기간 향상을 보여주지 못하였다. 반면 VEGFR2에 대한 항체의약품인 ramucirumab은 2차 치료용법 임상인 RAINBOW trial에서 화학요법과 병용치료는 생존기간 중간값은 7.4개월에서 9.6개월로, 무진행 생존시간 중앙값은 2.9개월에서 4.4개월로 향상시켰다 (2). 하지만 ramucirumab은 1차 치료용법 phase 2 임상에서 향상된 효능을 보이지 않음이 2014 ASCO Annual Meeting에서 발표되었다. AVAGAST와 RAINBOW 임상에서 특이점은 bevacizumab과 ramucirumab 모두 아시아 위암 환자에서는 특별한 효능을 보이지 않는다는 점이다. 그 원인으로 후속 요법의 차이가 제기되었지만, 지역 및 인종에 따른 유전적 차이에 대한 연구가 필요하다.
3. EGFR, HGF/MET, FGFR2 표적 치료제
HER2와 VEGFR2 이외에 위암 환자에서 관찰되는 receptor tyrosine kinase(RTK)인 EGFR, MET, FGFR2 표적 치료제에 대한 임상들이 진행되고 있지만 아직까지 큰 성과를 이루고 있지 못하다. EGFR에 대한 항체의약품인 cetuximab, panitumumab, matuzumab, nimotuzumab 모두 1차 혹은 2차 치료요법 임상 모두에서 뚜렷한 효과를 보이는데 실패하였다. KRAS 변이가 없음에도 EGFR 표적 항체의약품이 효능을 보이지 않는 원인에 대해서는 추가 연구가 필요한 실정이다. MET에 대한 표적치료제인 onartuzumab, foretinib, tivantinib에 대한 임상 2상 연구들 역시 실망스러운 결과를 보였다. MET의 리간드인 HGF에 대한 표적치료제인 rilotumumb 역시 임상에서 효과를 보이는데 실패하였다. 더욱이 이들 HGF/MET 억제제들은 임상에서 심각한 독성을 나타내는 문제점들이 보고되고 있다. FGFR2 표적치료제인 dovitinib과 AZD4547에 대한 임상인 진행 중에 있지만 AZD4547이 2차 치료요법 임상에서 무진행 생존기간 향상 효능이 없음이 보고된 상태이다.
4. PI3K/AKT/mTOR 표적치료제
PI3K/AKT/mTOR 신호전달계는 위암의 증식과 생존에 관여하고 약 60%의 위암 환자에서 활성화된 것으로 알려져 있다. 현재 PI3K 억제제인 BYL719와 Akt 억제제인 MK-2206의 초기 임상 연구가 진행되고 있으며, mTOR 억제제인 everolimus에 대한 임상 3상이 진행되고 있다. 하지만 everolimus가 임상 3상 GRANITE-1 trial에서 생존기간 향상을 보이지 않는다는 결과가 보고됨에 따라 PI3K/AKT/mTOR 억제제들의 적절한 환자군 설정을 위한 biomarker 연구의 필요성이 제기되고 있다.
5. Immune checkpoint 억제제
전이성 흑생종에서 면역체크포인트 (immune checkpoint) 억제제가 탁월한 효능을 보임에 따라서 위암 환자들을 대상으로 한 초기 임상들이 진행되고 있다. 위암 환자의 40-60%에서 PD-L1이 과발현되며, 이런 과발현이 위암 환자의 낮은 생존율과 관련이 있는 것으로 보고되고 있다. 2014 European Society for Medical Oncology meeting에서 발표된 PD-1 억제제인 pembrolizumab의 임상 1상 결과에 따른 162명 중 65명 환자에서 PD-L1 과발현이 확인되었으며, 이들 중 39명을 대상으로 한 연구에서 pembrolizumab의 반응률은 22%였다. CTLA-4 억제제인 tremelimumab과 ipilimumab에 대한 소규모 임상 2상이 완료된 상태인데, 발표된 tremelimumab의 효과는 크지 않았고, ipilmumab의 결과는 아직 발표되지 않았다. 위암 환자에서 면역체크포인트 억제제의 단독 혹은 다른 표적치료제와의 병용요법의 효능에 대한 앞으로의 연구결과들도 관심이 되고 있다..
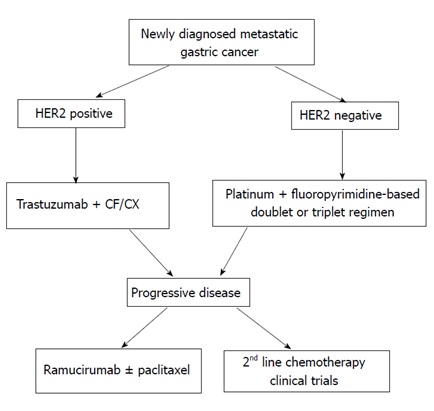
그림. 진행성 위암에 대한 기존 표적치료제 전략 (Kanat O, et al., 2015)
6. 마치며
위암은 암병리학상 다양성을 가지고 있으며 환자에 따라 임상적 경과가 다양하여 오랜 기간 치료하기 어려운 암 중의 하나였다. 최근 위암의 분자적인 특성 분석을 통한 분류법이 제기되었으며, 이런 이해를 통하여 표적치료제들의 효과적인 임상개발 전략이 개발될 수 있을 것으로 기대된다 (4). 최근 진행성 위암에 대한 HER2와 VEGFR2 표적치료제의 성공적인 임상 결과는 위암 치료의 새 장을 열어가고 있다. 그럼에도 불구하고 추가적인 표적 치료제의 기대에 미치지 못하는 임상결과들은 위암 치료제 개발의 어려움을 대변하고 있다. 더욱이 1차 치료용법을 위한 표적치료제는 trastuzumab이 유일하며 유방암에서의 pertuzumab의 병용 시너지효과와 같은 위암 특유의 병용치료제 개발 등의 돌파구를 기대해 볼 수 있다. 앞으로도 진행성 위암 환자의 생존 향상을 위해 HER2 표적치료제의 도전적 개발 및 추가 표적치료제들의 적정 환자군 선정을 위한 biomarker 연구가 절실한 실정이다.
참고문헌
1. Bang YJ, et al., Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-esophageal junction cancer (ToGA): a phase 3, open-label, randomized controlled trial, Lancet, 2010, 376:687-97.
2. Wilke H, et al., Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomized phase 3 trial. Lancet Oncol, 2014, 15:1224-1235.
3. Kanat O, et al., Targeted therapy for advanced gastric cancer: a review of current status and future prospects, World J Gastrointest Oncol, 2015, 7:401-410
4. Cancer Genome Atlas Research Network, Comprehensive molecular characterization of gastric adenocarcinoma, Nature, 2014, 513:202-209