알츠하이머병과 치료제 개발
범부처신약개발사업단 정지영 전문위원
1. 질환 개요
알츠하이머병(AD)은 기억과 인지기능의 진행성 상실로 특징지어지는 퇴행성 신경 질환이다. 알츠하이머병은 전 세계적으로 고령자에서 치매를 일으키는 가장 흔한 원인이다. 현재 전 세계적으로 치매를 앓고 있는 환자의 수는 3560만 명에 달하며 2030년에는 6570만명에 달할 것으로 추정된다. (GlobalData, Mar. 2011)
알츠하이머병은 초기 단계에서는 인지하기 어렵고, 이 단계의 주된 호소증상으로 건망증이 증가하는 경우가 많은데 이는 배우자나 가족이 알게 되는 경우가 종종 있다. 건망증이 심해지고 기억과 다른 인지 영역의 진행성 손실(예를 들면, 언어, 행동, 실행기능)이 뚜렷해지면 알츠하이머병에 걸렸다는 사실은 더욱 확실해진다. 치매 증상이 불가피하게 악화되면 환자는 스스로 먹거나 옷을 입는 것과 같은 기본적인 활동도 할 수 없게 된다. 따라서, 알츠하이머병 환자는 일상 생활의 활동에서 도움을 받기 위해 가족이나 전문 간병인에게 점점 많이 의존하게 되며 결국 요양원이나 다른 장기 간호시설에 들어가야 할 수 있다. 질병의 진행기간으로 10년 이상 걸리는 경우가 많기 때문에, 사회에 막대한 사회적 및 재정적 부담을 끼치며 가족 구성원에게 심각한 정서적 고통을 주고 있다.
2. 발병 기전과 원인
알츠하이머병의 발병 기전과 원인에 대해서는 아직까지 정확히 알려져 있지 않으며, 현재까지 신경전달물질인 아세틸콜린 합성 감소, 베타 아밀로이드(beta-amyloid)의 침착, 타우(Tau)의 과인산화로 인한 신경세포의 손상이 주된 원인으로 알려져 있다. 그 외에도 apoE 유전자, α-synuclein 단백질 변화, 산화 스트레스, 노화에 따른 미엘린(myelin) 파괴 등도 뇌 세포 손상에 기여하여 치매 발병에 영향을 미치는 것으로 알려져 있다.
그림 1. Some key players in the pathogenesis of Alzheimer’s disease
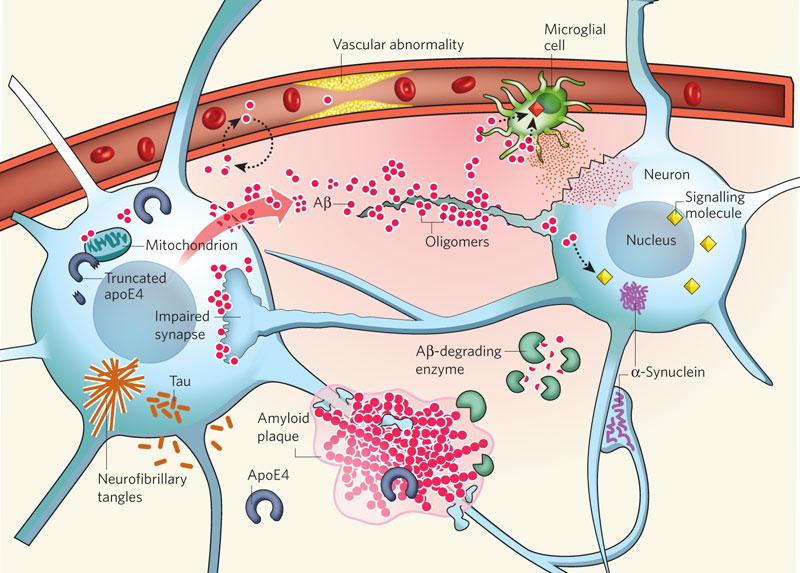
출처: Nature(2009) 461:895-897
3. Unmet medical needs
3.1치료약물 현황
현재까지 알츠하이머병을 근본적으로 치료할 수 있는 약물은 없으나, 아래와 같은 증상을 완화시키고 진행을 지연시키는 약물들이 있다.
표 1. Key treatments currently approved for Alzheimer’s disease across the seven major markets, 2011
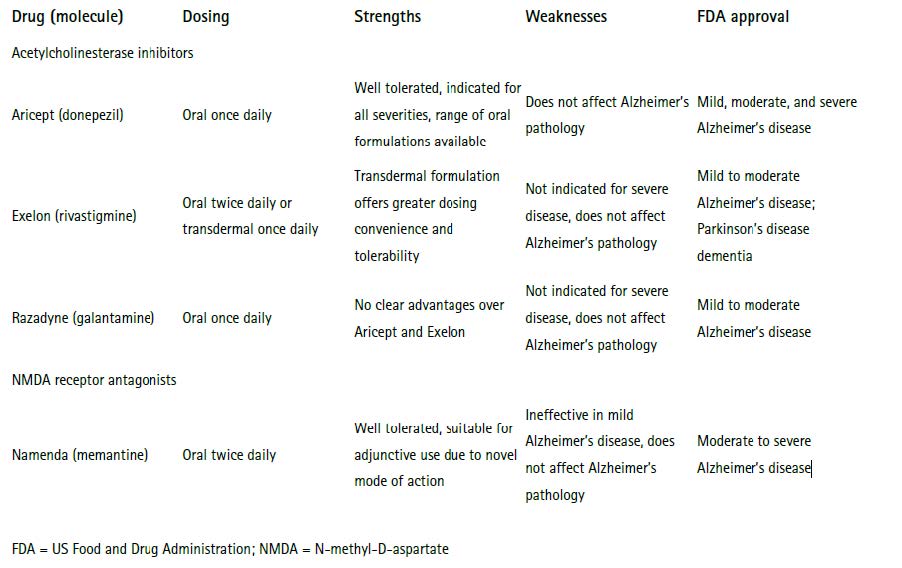
출처: Datamonitor, 2011
3.2 미충족 의학적 수요
AD 약제로 사용되고 있는 아세틸콜린 분해효소 억제제와 NMDA 수용체 길항제는 일시적으로 증상만 완화시키고 병의 진행을 일부 지연시키는 효과만이 있어 diseasing modification 치료제에 대한 미충족 수요가 높다.
그림 2. Opportunity and Unmet Need in the Dementia Therapeutics Market, 2010
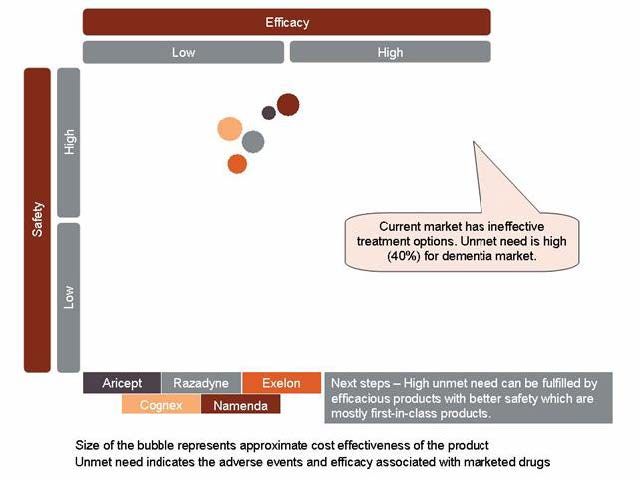
출처: GlobalData, Prescribing Information, Company website
3.3 Pipeline 분석
1998년부터 2011년까지 101개의 알츠하이머병 치료제 개발이 실패로 돌아갔으며 같은 기간 단 3개의 약물만이 승인을 받았다. 또한 최근에 관심을 모았던 amyloid-β peptides를 인식하는 항체인 Bapineuzumab(Pfizer)와 Solanezumab(Lilly) 및 면역글로블린 기반(immunoglobulin-based) 약물인 Gammagard (Baxter)에 대한 3상 임상이 모두 실패 또는 부분 실패로 돌아감으로써 알츠하머병 치료제 개발의 험난함을 더욱 실감하고 있다.
그림 3. Unsuccessful Alzheimer’s Drugs in Development, 1998-2011
Total unsuccessful drugs=101
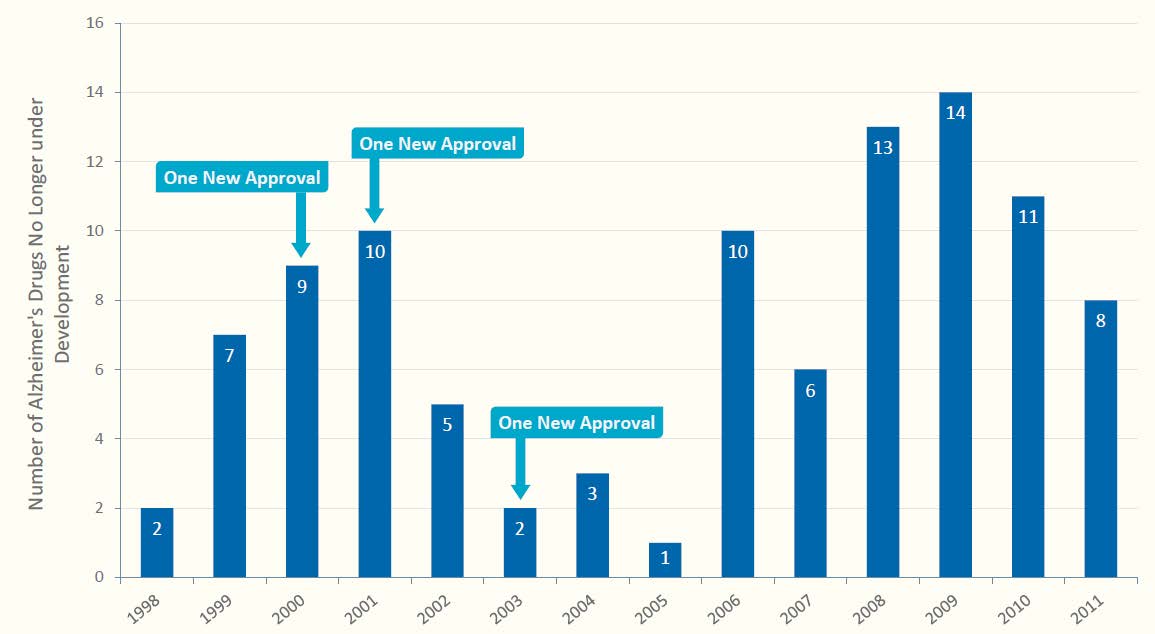
출처: Pharmaceutical Research and Manufacturers of America. “Researching Alzheimer’s Medicines: Setbacks and Stepping Stones.” Washington, DC: PhRMA, September 2012.
현재 다양한 기전의 물질이 임상단계에서 개발 중이다. 아래 그림에서와 같이 beta amyloid를 target으로 하는 기전의 약물이 40%를 차지하고 있으며 neurotransmitter 기전의 약물이 33%를 차지하고 있음을 확인할 수 있다.
그림 4. Alzheimer’s disease clinical pipeline, by mode of action, November 2012
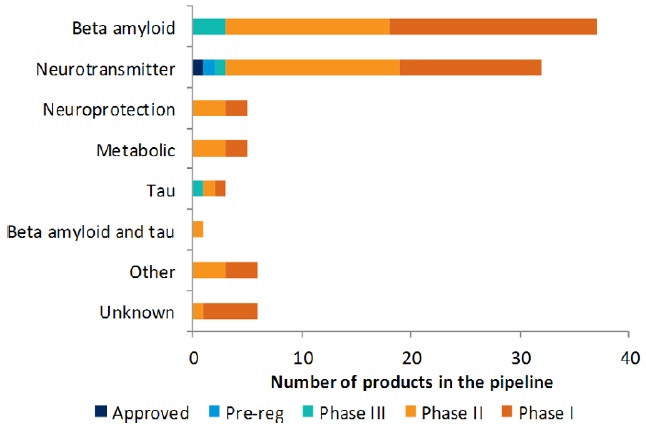
출처: Datamonitor; Citeline Pipeline Database 2012
2012년 11월 기준으로 아래와 같이 알츠하이머병에 대한 95개 물질의 임상시험이 진행되고 있다. (Citeline Pipeline Database, 2012).
표 2. Alzheimer’s disease clinical pipeline, by developmental stage, November 2012
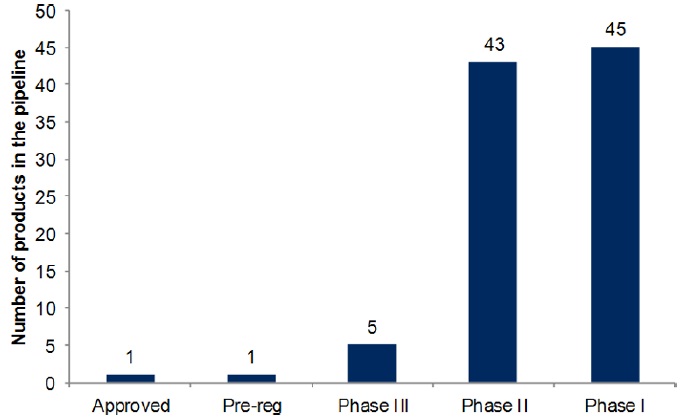
출처: Datamonitor; Citeline Pipeline Database 2012
주요한 임상시험 현황은 아래와 같다.
표 3. Key pipeline products for Alzheimer’s disease, 2013
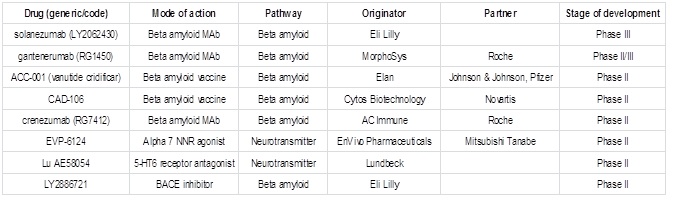
출처: Datamonitor (modified)
4. 임상시험 디자인
4.1 전형적인 알츠하이머병 임상시험
전형적인 알츠하이머병 임상시험 디자인은 Cholinesterase inhibitors의 개발과정에서 개발되었다. 증상을 완화하기 위한 신약의 3상 임상시험은 인지기능(예, ADAS-cog 등)과 일상생활 수행 능력(예, CDR, CDR-SOB, ADCS-ADL, DAD 등)에 대한 이중 평가(co-primary outcome)를 바탕으로 하는 이중눈가림, 위약 대조, 평행군 시험의 디자인이 일반적이다. 이러한 전형적인 디자인에서 피험자는 시험약 또는 위약에 배정되고 3, 6 또는 12개월 후에 베이스라인으로부터의 변화를 측정하게 된다. 즉, 이러한 연구의 목표는 인지능 개선이 환자에게서 임상적으로 의미 있는 기능/일상의 개선과 관련이 되어 있다는 것을 확인하는데 있다.
한편, 알츠하이머병에 대한 disease-modification을 입증하는 전형적인 임상시험 디자인은 성공사례가 없는 관계로 아직까지는 없다.
표 4. Typical Phase III clinial trial design in Alzheimer’s disease

출처: ClinicalTrials.gov(NCT00675623); Medivation, 2010
4.2 Disease modification 입증 임상시험
Disease modification을 입증하기 위해서는 바이오마커의 변화가 임상적인 효과를 유발한다는 것을 보여 주는 방법이 있다. 하지만 현재까지는 알츠하이머병 임상시험에서 임상적인 변화를 지지하기에 적절한 특정 바이오마커에 대한 일치된 의견은 없는 상황이다. 따라서 최근 FDA Draft Guidance(Alzhmeimer’s Disease: Developoing Drugs for the Treatment of Early Stage Disease, February 2013)에 의하면 초기 알츠하이머병에 대한 임상시험에서 바이오마커만으로 효과를 평가하는 것은 아직 이르며 임상적인 평가와 함께 이차 평가 지표로써 바이오마커를 활용하는 것을 권장하고 있다.
이외에도 Randomized Withdrawal 또는 Staggerd start 임상시험 디자인을 통해서 Disease modification을 입증하는 방법이 있다. 윤리적인 면을 고려하면 Staggerd start 디자인이 더 적절할 것으로 보인다. 본 디자인에서는 피험자가 위약이나 시험약에 배정되었다가 일정 시점 후부터 위약을 투여 받은 환자는 시험약을 투여받게 된다. 만약 처음에 위약을 투여받은 환자가 시험약을 투여 받고 나서 적절한 시점에 처음부터 시험약을 투여 받은 피험자와 같은 정도의 인지/기능에 도달하지 못한다면 그 약제는 disease modification 효과가 있음을 보여 준다고 할 수 있다. 하지만 아직까지 이러한 디자인이 임상시험에서 성공적으로 사용된 사례는 없다.
그림 5. Clinical trial designs proposed to determin disease modification
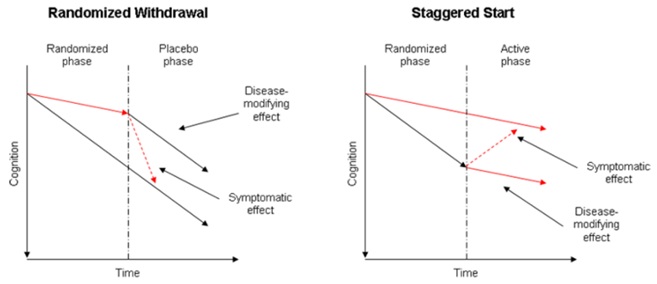
출처: Datamonitor, adapted from Myriad (2007)
4.3 초기단계의 알츠하이머병(Early-stage Alzheimer’s Disease) 임상시험
최근 학계에서는 알츠하이머병이 너무 많이 진행되어 뇌의 손상이 비가역적인 단계에 이르기 전에 초기 단계의 환자를 진단하고 치료하는 것에 대한 중요성이 대두되고 있다. 이에 초기 단계의 알츠하이머병에 대한 임상시험이 증가하는 추세이며, 최근에 FDA에서는 초기단계 임상시험에 대한 draft guidance(Alzheimer’s Disease: Developoing Drugs for the Treatment of Early Stage Disease, February 2013)를 공지하였고 각계의 의견을 수렴 중에 있다. 주요한 내용은 초기단계의 알츠하이머병 환자의 경우 전반적인 일상생활 수행능력에는 거의 문제가 없어 임상시험에서 이러한 환자의 기능적 변화를 측정하기에는 현 시점에는 어려움이 있는 것을 인정하여 초기단계의 알츠하이머병에 대한 신약허가의 기준을 낮추고자 한다는 것이다. 그 예로써 인지기능과 사회적 활동 및 일상생활 기능을 종합적으로 평가하는 Clinical Dementia Rating-Sum of Boxes(CDR-SB) score와 같은 혼합 스케일(composite scale)을 단독 평가지표로 사용하는 것도 하나의 방안이 될 수 있다고 안내하고 있다.
5. 시장전망
2010년 알츠하이머병 시장은 약 $9,746 million 규모로 1.7%의 성장률을 보여 2017년에는
$10,978 million에 도달할 것으로 예측된다. (GlobalData, Mar. 2011)
그림 6. Dementia Therapeutics Market, Global, Revenue and Forecasts ($m), 2005–2017
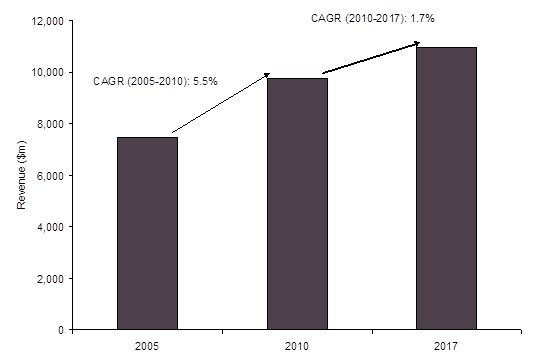
출처: Globaldata; Epidemiology-Based Market Forecasting Model, Primary Research Interviews, Key Opinion Leader (KOL) Interviews









