면역체크포인트 억제제를 통한
항암치료제 패러다임의 전환과 그 너머
다이노나㈜ 개발팀장 윤상순
10 년 전에만 해도 전이성 흑색종 (metastatic melanoma) 진단 결과는 사망선고와 다름없었다. 진단받은 환자의 반이 1 년 안에 사망하였으며, 거의 대부분이 5년 안에 사망했기 때문이다. 그러나, 2010년 들어 전체생존기간 (overall survival; OS)이 5년은 넘는 결과가 나오기 시작했으며, 최근의 메타 분석에 의하면 10년 이상 생존할 수 있다는, 이른바 완치를 얘기할 수 있는 수준의 결과가 나오게 되었다.
이러한 획기적인 결과는 이필리무맙 (Ipilimumab, anti-CTLA4; BMS) 항체치료제에 의해 도출되었으며, 종양미세환경에서 영향을 미치고 있는 PD-1에 대한 항체인 니볼루맙 (Nivolumab; BMS)과 펨브롤리주맙 (Pembrolizumab; Merck)이 2014년 미 FDA에 신약으로 승인되면서 면역체크포인트 억제제 기전의 새로운 항암제 분야에 전 세계 신약개발자들이 주목하게 되는 계기가 되었다.
2015년 NEJM에 발표된 전이성 흑색종 환자에 대한 이필리무맙과 니볼루맙의 병용치료 결과1)는 각각의 단일 치료군보다 병용치료군의 무진행 생존기간 (Progression free survival; PFS)이 2.9개월, 6.9개월에서 11.5개월로 획기적으로 증가하였다. 더욱 놀라운 점은 병용치료군에서 3~4 수준의 이상반응(adverse events)을 보여 투여 중단을 했음에도 불구하고, 중단한 환자 중 68%에서 지속적인 치료 반응이 유지되었다는 점이다2). 이는 전이성 흑색종에 대한 기본 치료요법을 항암화학 치료요법에서 면역치료 요법으로 근본적인 변화를 유도하게 되었다.
종양 유발성 세포들은 우리 면역 시스템에 의해 지속적으로 감시되고 제거된다. 따라서, 종양세포들이 면역 감시 시스템을 회피하기 위한 유일한 전략은 면역시스템을 억제하는 방향이다3). 진화적으로 건강한 우리 신체의 항상성 (homeostasis)를 유지하기 위해 확립된 면역 활성화 시스템과 면역 억제화 시스템(면역 체크포인트; Immune Checkpoint)에서 종양세포는 면역 억제 강화를 유도하는 방향으로 생존전략을 꾸린 것이다. 이러한 종양세포의 생존전략은 선도적인 과학자들의 노력으로 일부 타개되었으며, 이러한 시도는 지금까지 경험하지 못했던 지속적인 치료 반응을 보이는 환자들의 임상적 성공으로 귀결되었다.
면역체크포인트 억제제의 성공으로 촉발된 면역치료요법 개발은 다양한 면역 조절 경로 또는 면역 조절자들을 자극 또는 억제하는 방향으로 항암 신약 개발 및 연구가 진행되고 있다. 또한, 이러한 최근 개발 전략은, 앞서 면역체크포인트 억제제인 두 항체의 병용치료요법으로 더욱 의미 있는 임상결과를 얻은 바와 같이, 병용치료요법을 기본 축으로 설정하고 있다.
면역치료요법에서 좀 더 지속 가능한 임상치료적 결과를 도출하기 위한 병용 파트너 전략에서 가장 중심적인 키워드를 뽑는다면, T 세포이다. 세포를 좀 더 종양세포에 근접하게 유도하기 위한 전략(Tumor infiltrating T cells; TILs), 종양세포에 근접했어도 활성과 억제의 반복으로 탈진한 T 세포 (exhausted T cells)를 활성화 시키기 위한 전략이 모든 병용 조합의 목표인 것이다.
종양면역학적인 관점에서 면역반응 유형에 따라 암은 세 종류의 그룹으로 나눌 수 있다4). 이러한 세 그룹 암에 대한 각각의 치료요법에서도 T 세포의 유인 또는 활성화 전략이 핵심이다.
표1. 면역반응에 따른 항암 면역치료 요법
|
면역 반응 그룹 |
종양 미세 환경 |
면역 회피 전략 |
면역치료요법 목표 |
잠재적인 면역치료요법적 접근 방법 |
|
면역원성(Immunogenic) |
종양 내 많은 수의 살상 T 세포 |
면역체크포인트 (PD1, LAG3, CTLA4 등) |
종양 내 살상 T 세포의 활성화 |
면역체크포인트 억제제 |
|
염증성(Inflammatory) |
많은 수의 림프구 및 골수성 억제 세포들의 투과, 높은 신생혈관작용, Stromal mesenchymal 세포 |
저산소증(hypoxia), TGF β, PD1 |
염증 관련 억제 기전의 감소, 산소 정상 상태(normoxia), 종양 내 억제되어있는 살상 T 세포의 활성화 |
항 신생혈관억제 및 항 TGF β 요법, 면역체크포인트 억제제 |
|
면역 방임성 (Immune Neglected) |
적은 수의 림프구 및 골수성 억제 세포들의 침투 |
낮은 MHC class I 발현 |
종양 내로 살상 T 세포의 유인, MHC class I 제공 무시 |
CAR T cells, 이중 항체 |
T 세포 활성화를 통한 항암 신약 개발 전략으로는 T 세포를 직접 자극하는 ?면역체크포인트 억제, ?보조활성 인자 자극 방법과, 기타 다른 면역 세포들의 자극을 통한 간접적인 T 세포 자극 방법인 ?면역억제 유발 인자들의 억제 ? 화학요법 및 방사선요법을 통한 면역반응의 자극 등으로 구분 지을 수 있으나, 실제로는 제시된 모든 접근 방법의 복잡한 조합으로 매우 다양하게 개발되고 있다.
표2. T 세포 활성화 전략
|
T 세포 활성화 전략 |
예 |
|
|
직접 결합을 통한 활성화 |
? 면역체크포인트 억제 |
PD-1, CTLA-4, LAG-3, TIM-3, CEACAM1, etc. |
|
? 보조활성 인자 자극 |
OX40, CD137, CD27, CD40, etc |
|
|
간접적인 활성화 |
? 면역억제 유발 인자들의 억제 |
Treg, MDSC, TAM, IDO, PD-L1, etc. |
|
? 화학요법 및 방사선요법을 통한 면역반응의 자극 |
Chemotherapy, radiotherapy를 통한 immunogenic cell death 유도 |
|
따라서, 전통적인 항암화학요법부터 표적지향성 치료요법, 방사선요법 등은 여전히 항암치료요법으로서 의미 있으며, 좀 더 지속 가능한 임상결과를 도출하기 위한 면역치료요법 간, 또는 기존 항암요법과 면역치료요법 간의 다양한 시도가 면역체크포인트 억제 항암제의 출현으로 촉발되어 매우 활발히 진행되고 있다. 아래 그림과 같이 일부 항체치료제 간의 조합에 대한 시도가 2007년 당시 비임상 단계에서만 진행되었다면, 2015년에는 서로 다른 기전의 다양한 요법 간의 병용 시도가 임상시험에까지 적용되고 있음을 알 수 있다5).
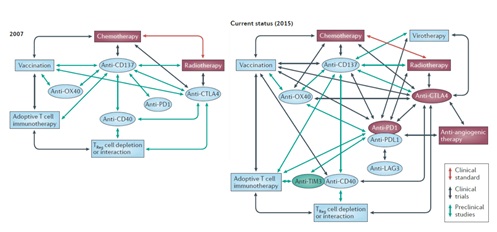
그림 1. 면역치료요법 병용 개발의 진화
이러한 경향은 면역체크포인트 억제제인 각각의 항체치료제를 중심으로 한 병용치료요법의 임상시험이 2016년 1월 기준으로, 이필리무맙 (anti-CTLA4 항체; BMS) 256 건, 니볼루맙 (anti-PD-1 항체; BMS) 162건, 펨브롤리주맙 (anti-PD-1 항체; Merck) 214건 진행되고 있으며6), 아직 승인이 되지는 않았으나 2015년 획기적 치료제 지정 (Breakthrough therapy designation)을 받은 아테졸리주맙(atezolizumab, anti-PD-L1 항체, Roche) 도 40 건의 임상시험을 진행 중에 있다.
면역체크포인트를 정점으로 한 항암 면역치료요법은 획기적인 임상성공에도 불구하고, 면역체크포인트 항암제에 반응하지 않는 암이 여전히 우세하며, 반응하는 암이라 하더라도 지속적인 치료적 반응을 보이는 환자 군은 적은 비율에 불과하다. 이러한 점은 이제 겨우 암 치료의 희망에 가까이 다가서긴 했으나, 여전히 개발하고 성취해 내야 할 부분이 많음을 시사한다. 그러나, 면역감시 시스템의 기전과 종양 세포의 면역 회피 전략에 대한 개별 종양의 기전에 대한 이해가 좀 더 깊어질수록, 다양한 병용요법 조합에 대한 선택적 성공 사례가 늘어갈수록, 개개인의 생물학적, 유전학적, 종양면역학적인 특성 구분의 지식이 늘어갈수록 암 치료의 문턱은 낮아질 것이다. 전 세계 기초 및 임상과학자와 신약개발자들의 노력은 아래 그림에서 전망하는 암 환자 생존기간의 반응율은 올리고, 생존기간은 지속시키는 성과를 멀지 않은 시기에 이루어 낼 것이다.
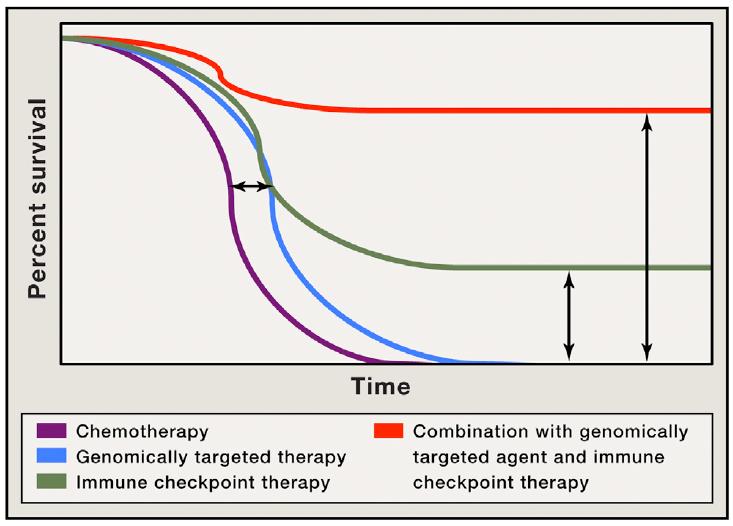
그림 2. 병용치료를 통한 암 환자의 전체 생존기간(overall survival; OS)의 증대 및 치료적 반응의 지속성 전망
<참고 자료>
1. Larkin J. et al, Combined nivolumab and ipilimumab or monotherpy in untreated melanoma, NEJM 2015. 373:23-34
2. Hodi et al. Clinical response, progression-free survival, and safety in patients (pts) with advanced melanoma receiving nivolumab combined with ipilimumab vs ipilimumab monotherapy in CheckMate 069 study, abstract #9004, ASCO 2015
3. Munn, D.H. et al, Immune suppressive mechanisms in the tumor microenvironment, Curr Opi. In Immunology 2016, 39:1-6
4. Becht E. et al, Cancer immune contexture and immunotherapy, Curr Opi. In Immunology 2016, 39:7-13
5. Melero I. et al, Evolving synergistic combinations of targeted immunotherapies to combat cancer, Nature Reviews CANCER 2015. 15:457-472
6. http://www.clinicaltrials.gov
7. Allison, J. P. et al. Immune Checkpoint targeting in cancer therapy: Toward combination strategies with curative potential, Cell 2015, 161: 205-214
이전
다음
2016.03.07