CAR-T 치료제 시장의 미래
이선경 (재)범부처신약개발사업단 사업개발팀 연구원
(본 기고는 Nature Reviews of Drug Discovery, 2018년 3월호에 게재된 “The market for chimeric antigen receptor T cell therapies”의 내용을 바탕으로 작성하였다.)
2017년은 항암제 개발에 있어서 가장 주목할 만한 한해였다. 재발/불응성 B세포 급성 림프구성 백혈병 CR(Complete Remission) 80%란 놀라운 효능을 보인 CAR-T 치료제가 2017년 9월 FDA에서 최초로 승인됨에 따라 혈액암 치료제의 새로운 패러다임을 제시하였기 때문이다.
2007년 3개, 2014년 30여개에 불과하였던 CAR-T의 임상 파이프라인은 2017년 1월 기준 373개로 급증하였으며, 이러한 흐름을 반영하여 Baxalta, Genentech, Takeda, Pfizer 등 빅파마들도 기술거래 및 M&A등을 통하여 CAR-T 개발에 박차를 가하고 있다. (표 1)
(표 1) CAR-T 기술 협력 현황
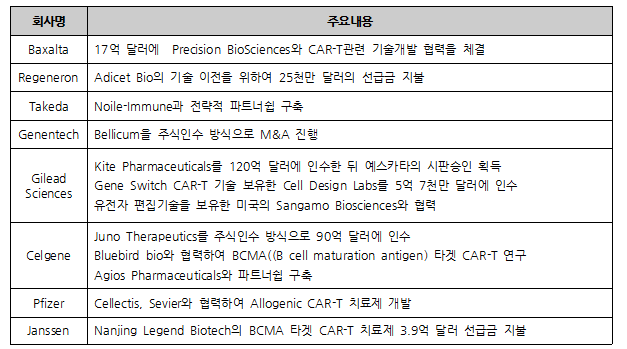
※ 본 표는 각 회사 홈페이지를 참고하여 작성함
그러나 CAR-T 시장이 얼마나 성장할 수 있을지에 대해서는 좀 더 꼼꼼하게 살펴볼 필요가 있다.
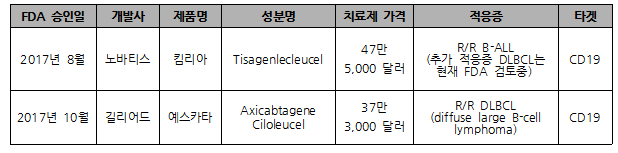
미국 기준, 매년 B-ALL로 진단받는 3,000여명의 환자 중 기존치료제(클로파라빈, 블리나투모맙, 동종 조혈모세포이식)에 반응하지 않거나 내성이 생긴 환자(R/R B-ALL)의 비율은 15%(연간 450여명)이다. 노바티스의 킴리아가 타겟하는 시장은 내성발생 및 불응환자(R/R B-ALL)를 대상으로 하고 있으며, 1회 치료비용은 47만 5천 달러이다. (표 2)
영국의 의료기술평가기관인 NICE(National Institute for Health and Care Excellence)에서는 1QALY(Quality Adjusted Life Years)당 3만파운드(약 4만 3천달러)를 넘으면 경제성이 없다고 판단하고 있는데, 2018년 ICER(Institute for Clinical Economic Review)에서는 킴리아와 예스카타의 1QALY 당 비용을 베이스 시나리오 기준, 각각 4만 6천달러와 13만 6천달러로 평가하고 있다. (표 3)
그렇다면 CAR-T 치료제가 시장에서 경쟁력을 갖기 위해서 해결해야하는 문제는 무엇일까?
(표 2) CAR-T 치료제 현황
(표 3) 2018 ICER의 CAR-T 베이스 시나리오 분석 결과
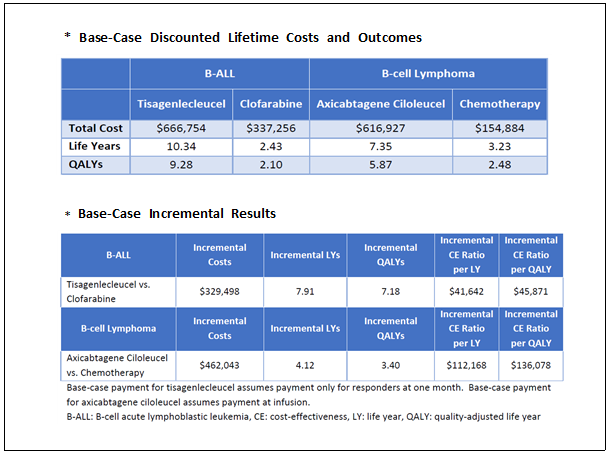
출처: Chimeric Antigen Receptor T-Cell Therapy for B-Cell Cancers: Effectiveness and Value, ICER, 2018.02
1) 안전성 개선
CAR-T 치료제는 사이토카인 릴리즈 신드롬(CRS)과 신경독성의 부작용에서 아직 자유롭지 못하다.
킴리아와 예스카타의 주요 경쟁자로 언급되었던 주노테라피의 후보물질(JCAR015)은 뇌부종으로 인한 5명의 사망자가 발생함에 따라 2016년 임상을 중단하였으며, 킴리아와 예스카타도 CRS와 신경독성 부작용에 대한 이슈에 즉각적으로 대응하기 위하여 Risk Evaluation and Mitigation Strategy Program(치료 후 관찰 추적)을 진행하고 있다.
현재 가장 오랜 시간동안, 많은 연구가 진행되고 있는 타겟은 CD19이다. CD19는 B 세포 표면에 발현되는 항원으로 암세포와 정상세포에서 모두 발현되는 마커이기 때문에 CAR-T가 정상세포에서도 활성화되어 지나친 면역증진으로 인한 CRS와 신경독성이 발생하게 된다. 이를 해결하기 위하여 Tumor Specific Antigen(TSA)을 타겟하는 치료제 개발과 활성화된 CAR-T를 조절 할 수 있는 Gene Switch 개발이 시도되고 있다.
BCMA는 혈액암 치료제로 최근 가장 각광받고 있는 타겟으로 다발성골수증(Multiple myeloma)세포에서만 발현되기 때문에 적어도 정상세포에서 CAR-T가 활성화 되어 발생되는 문제에 대해서는 자유로울 수 있다. 현재 Bluebird Bio, Nanjing Legend, Gilead, Autolus 등이 개발하고 있으며, 다발성 골수증 환자를 대상으로 한 임상에서 Bluebird Bio의 치료제는 ORR 94%, CR 56%, CRS는 10%, 신경독성은 18명 환자 중 1명 발생해서 상대적으로 높은 안전성 결과를 보여주었다.
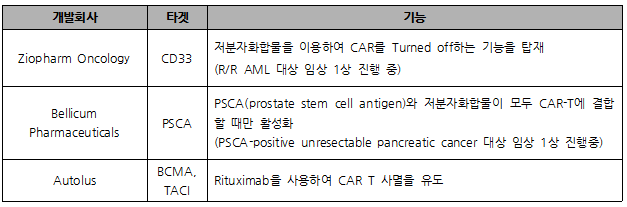
Gene Switch는 저분자 화합물을 이용하여 CAR-T의 발현을 조절하는 기술로, 반감기가 긴 CAR-T(4주 ~129주) 치료제의 안전성 제고를 위해서는 필수적인 기술이라 할 수 있다. (표 4)
(표 4) Gene Switch CAR-T 치료제 개발 현황
2) 고형암 치료제 개발
고형암 시장은 Unmet Medical Needs가 매우 높은 분야로, 시장성 확장 측면에서 고형암 치료제 개발은 매우 중요한 이슈이다. 많은 개발자들이 고형암 치료를 위한 CAR-T 개발을 다양하게 시도하고 있지만 아직까지 낮은 효능을 극복할 할 수 있는 뚜렷한 해결책은 없는 상태이다.
그렇다면 고형암을 타겟하는 것이 왜 이렇게 어려운 문제일까? 해답을 찾기 위해서는 고형암의 주요 특징에 대해서 좀 더 알아볼 필요가 있다.
먼저 Heterogeneity Antigen의 문제이다. 고형암은 발생 원인이 매우 복잡할 뿐 아니라 환자마다 각각의 변이가 있어 Tumor Specific Antigen(TSA)과 Tumor Associated Antigen(TAA) 발견이 매우 어렵다. 때문에 현재 치료되고 있는 치료제의 대부분이 TSA 또는 TAA를 타겟하고 있는 것이 아니라 암세포에서 특이적으로 과발현 되는 혈관신생 리셉터를 중심으로 설계되고 있다. TSA를 발견을 한다 하더라도 안전성은 또 다른 문제이다. TSA인 Her2를 타겟하는 치료제의 임상시험도중 환자가 사망한 사례가 있어서 TSA을 타겟 하는 것이 곧 안전성을 의미하는 것은 아니다.
두 번째는 Microenvironment로 인한 어려움이다. 고형암에서 분비되는 사이토카인과 주변 세포의 영향으로 Immunosuppressive한 환경이 조성되는데 이는 T 세포의 활성을 저해하는 주요 원인으로 작용하고 있다. CAR-T가 효능을 잘 발휘하기 위해서는 타겟하는 리셉터로 잘 이동하여 활성화되어야 되는데 암세포는 CXCL9, CXCL10 등의 발현하여 CAR-T가 암세포로 이동하는 것을 방어한다. 또한 T 세포의 활성을 직간접적으로 저해하기 위해서 TGF-β나 IL-10 등 면역반응을 억제하는 사이토카인을 분비하는 것은 물론 Treg, MDSCs 등 면역반응을 억제하는 세포들에게 시그널을 전달함으로써 면역시스템으로부터 자신을 보호한다. 이러한 면역억제 종양 미세환경 외에도 고형암 치료제로서 CAR-T가 효과를 발휘하기 위해서는 이미 잘 알려진대로 T 세포가 암세포 자신을 공격대상으로 인지하지 못하도록 면역회피인자(Immune Check Point)에 의한 암 세포의 방어기작을 넘어서야만 한다.
세 번째는 암세포 내 침투의 어려움이다. 암세포 주변은 기질이 풍부한 ECM(Extra Cellular Matrix)으로 둘려 쌓여 있다. 즉 물리적 장벽이 너무 견고하여 T 세포가 암세포 안으로 진입하기 어려운 것이다. T-세포 침윤(T Cell Infiltration)과 CAR-T 치료제의 치료 효능간 강한 상관관계가 존재한다는 지금까지의 연구결과를 고려한다면 ECM을 공략할 수 있는 방법을 찾는 것 역시 중요한 기술적 과제가 될 것이다.
네 번째는 암세포 안의 Immunosuppressive한 환경이다. 암세포의 견고한 방어 전략을 뚫고 암세포 내로 침투한 T 세포라 할지라도 낮은 pH, 부족한 영양소, 저산소등으로 인하여 활성화되기가 어렵다. (그림 1)
(그림 1) 고형암의 Immunosuppressive Microenvironment
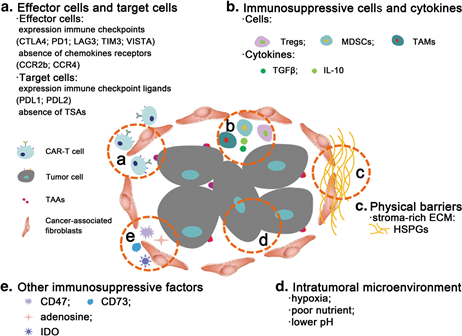
출처: Prospects for chimeric antigen receptormodified T cell therapy for solid tumors, Zhang et al. Molecular Cancer (2018)
이러한 문제점들을 해결하기 위하여 TGF-β, IL-2, IL-10 PD-1 negative receptor를 타겟하는 CAR-T를 개발하거나 IL-12와 같이 면역세포 기능 활성화 역할을 하는 사이토카인 발현 유전자를 삽입하는 방식으로 개발되고 있으며, 상업 임상은 5개의 중국 바이오기업을 중심으로, 연구자 임상은 미국의 주요 병원을 중심으로 진행되고 있다. 그림2는 고형암으로임상이 진행되고 있는 주요 타겟 현황이다.
(그림 2) 고형암의 주요 타겟 현황
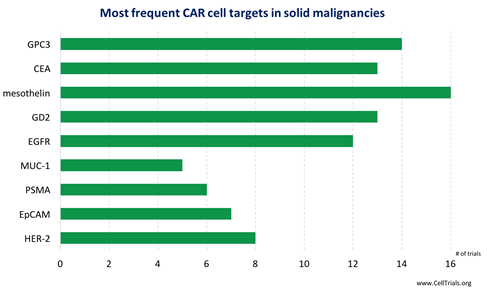
3) Off-the- Shelf 치료제 개발
CAR-T 치료제 가격은 35만 달러에서 50만 달러 수준이다. 이렇게 고가인 이유는 환자의 혈액에서 T 세포를 추출한 뒤 암세포를 인식할 수 있는 항원 수용체를 주입하고 증식시켜 환자의 몸속에 넣는 방식을 취하고 있기 때문이다. 세포를 추출하여 증산하는데 2~3주가 소요되고, 생산비용만 15만 달러 ~35만 달러가 필요한데 이렇게 만들어진 세포는 해당 환자에게만 사용할 수밖에 없어 단가를 낮추는 것은 거의 불가능에 가깝다.
이를 해결하기위해서는 Allogenic 치료제의 개발이 중요한 과제인데 유전자편집기술과 NK(Natural Killer)세포를 이용한 방법이 시도되고 있다.
유전자편집기술을 이용한 Allogenic CAR-T 치료제의 대표기업으로는 Cellectis가 있다. 건강한 사람에게서 채취한 T 세포를 조작하여 사용하는데, CD123 타겟의 Allogenic CAR-T 치료제 임상1상 시험도중 사망자가 발생하여 프로토콜을 저용량으로 변경하여 현재 임상을 다시 진행하고 있다.
NK세포는 Innate 면역체계로 타겟 비특이적인 방식으로 작동하여 이식거부 반응에 대한 위험성이 상대적으로 낮은 것으로 보고되고 있다. 따라서 양산형 치료제로 개발이 가능할 것으로 기대되지만 T세포에 비해서 치료효과가 상대적으로 낮은 문제를 해결해야만 한다. 주요 기업으로는 녹십자랩셀, PersonGen BioTherapeutic, Celgene, Celyad, Fate therapeutics, iCell Gene Therapeutics, Ziophrarm 등이 있다.
<참고문헌>
1. The market for chimeric antigen receptor T cell therapies, Nature Reviews of Drug Discovery, 2018.03
2. Chimeric antigen receptor T cell (CAR-T) immunotherapy for solid tumors: lessons learned and strategies for moving forward, Journal of Hematology & Oncology, 2018
3. Chimeric Antigen Receptor T Cell Therapy: Challenges to Bench-to-Bedside Efficacy, Journal of Immunology, 2018
4. Prospects for chimeric antigen receptor modified T cell therapy for solid tumors, Molecular Cancer, 2018
5. Chimeric Antigen Receptor T-Cell Therapy for B-Cell Cancers: Effectiveness and Value, ICER, 2018.02
6. Analysis of published results of CAR-T cell therapy trials, 2017.09
7. Current Trends in Cell Therapy Global landscape of CAR cell therapeutic companies, 2018.02
이전
2017.12.12
다음
2018.04.25