신약 개발 R&D의 전략적 접근
큐어랜케어 리서치 문한림
1. 신약 개발 과정에 있어 성공이라 함은 무엇을 이야기하는가?
의료인과 환자들은 기존의 치료에 비해 안전하고 효과가 뚜렷하며 사용에 편리하고 환자 개인 또는 사회를 위해 경제적인 약, 즉 비용-효과가 좋은 또는 감당할 수 있는 약이 개발되기를 원한다.
항암제의 예를 들어 최근 10여년 사이에 성공 사례로 글리벡 (Gleevec/Glivec®, imatinib mesilate)을 들 수 있다. 글리벡은 BCL-ABL 유전자의 융합으로 인해 티로신 키나제의 활성이 높아져 발생하는 만성 골수성 백혈병을 표적으로 하는 저분자 약물이다. 글리벡은 백혈병과 GIST 두가지 적응증을 가지고 있다. 특히 만성 백혈병에서 예전에 3,5년에 불과하던 중앙생존율을 7년 이상으로 끌어 올린 획기적인 약으로, 암세포에 발현하는 BCL-ABL 단백질을 특이적으로 겨냥하므로 약물에 의한 이상 반응도 매우 제한적이다.
Gleevec®의 개발 당시, Novartis는 환자의 숫자가 제한되어 있고 약효가 그렇게 까지 오래 갈 것으로 예상하지 못하여 별로 긍정적으로 검토하지 않았다. 그러나 의과학자들이 기전과 약효에 대한 큰 기대를 표현하여 프로젝트를 진행하게 되었다. 약물의 임상 데이터가 처음 발표되자 마자 의사와 환자, 사회가 모두 열광적으로 환영하는 분위기에서 약물은 신속히 승인을 받게 되었으며, 예상을 뛰어 넘는 임상 효과로 특허 만료시까지 지속적인 성장세를 보였다
1.
2. 표적의 선택 – 첫 번째 관문
신약개발의 discovery 단계에서 후보 물질 선택 시점에 이르게 되면 약물의 작용 기전, 선도 물질의 확인, 최적화가 활성 물질의 제형과 더불어 결정되어 있어야 한다. 그리고 용해도, 안정성, 화학적 물리적 성상에 대한 데이터가 필요하다.
후보 물질을 선정함에 있어, 어떤 질환을 표적으로 할 것이며 어떤 과학적인 근거에 의한 것인지 하는 점은 매우 중요하다. 표적의 선택에 있어 가장 이상적인 것은 연구에 근거한 ‘First-in-class’이다. 그리고 효능을 개선시키거나 보다 치료 지수를 높여 기존의 표적을 개선하는 경우, 일반적으로 많이 사용하는 “ Me too” 약물로 분류할 수 있다. 표적 선정과정에서는 환자들까지 포함한 많은 전문가들이 같이 일을 하여야 하는데, 이때 고려하여야 할 일반적인 선정 기준은 다음과 같다
2.
1) 치료의 유용성과 과학적 근거를 찾기 위한 증거를 찾을 수 있는가?
2) 기존의 치료와 경쟁하여 보다 큰 이득을 보여 줄 수 있는가?
3) 개발 후, 투자 대비 경제적인 이익이 돌아올 것인가?
많은 학술 기관이 약물 개발의 기초 단계에서 일하고 있다. 그런데 이들은 상업 구조를 가진 회사들이 가지고 있는 기능이 없음으로 인해서, 다음과 같은 점들을 놓치는 수가 있다.
(1)Unmet needs 를 충족시킴과 더불어 상업적인 성공을 위한 전략
(2)R&D 의 궁극적인 목표의 설정
(3)Business case 및 방향 설정
(4)신약의 등록을 염두에 둔 개발
(5)특허
(6)정해진 시간 안에 궁극정인 재정적 이익의 회수
(7)투자에 대한 계산을 할 때, 인적 및 재정적 자원에 대한 원가
A. 재정적 자원: 액수와 용도
B. 인적 자원: 일반적으로 학술 기관에는 상업 구조가 없으므로 재정적 이득이나 투자에 대한 계산이 일반적으로 매우 추상적이거나 정확하지 않은 경우가 많다. 또한 홍보를 위한 조직이 없고, 프로젝트를 운영하는 전문적 기술이 있는 인원이 없으며, 경험을 가진 asset leader 가 부족하다.
3. Discovery 단계에서 고려 사항
1) 임상 전단계에 필요한 자료들
일반적으로 임상시험 단계에 이르면, 다음 진행에 필요한 데이터들이 다 준비되어 있어야 한다. 그러나 많은 경우 부족한 데이터가 발견되거나, 매우 제한적인 또는 최소의 데이터 만으로 임상을 가기 위한 준비가 끝났다고 판정하는 경우가 많다. 이로 인해 IND 검토 시 또는 연구비를 신청하는 단계에서, 다시 실험을 하러 돌아가야 하는 경우가 생기며, 이는 시간과 경제적인 손실로 돌아올 수 있다. 그러므로 매 단계에서 내부 또는 외부 전문가들에 의해 객관적인 잣대로 끊임없이 자료들을 확인하면서 개발을 진행하여야 한다.
항암제를 개발하는 경우 분자생물학적 역학 연구는 매우 중요하다. 예를 들어 EGFR 표적 항암제를 개발한다면, 표적 질환을 선정하기 위해 임상 조직에서 실제 발현 또는 돌연 변이를 고려한 유병률을 확인해야 한다. 그리고 이러한 임상 관련 연구는 표적 선정 과정에서 이미 시행되어야 한다. 실제 대부분의 다국적 제약회사들은 표적 선정 시 실제 조직 병리 표본들을 수백 건 이상 검사하여 역학 조사를 하며, 이 단계는 학술 기관들과 협력하여 일하는 경우가 대부분이다.
2) Discovery 단계에서 Go/No-Go decision
Discovery 단계에서 Go/No-go 의 결정은 아주 중요하지만 또 아주 어려운 일이기도 하다. 하지만 몇 가지 전략적으로 결정하여야 할 점이 있다. 우선 전략적인 No-go의 결정으로 “우리는 cytotoxic 항암제는 개발하지 않는다”와 같은 예를 들 수 있다. 또한 이미 하나의 회사가 가지고 있는 상업 조직과 synergy를 이룰 수 있는 약을 우선적으로 개발한다든지, 또는 이미 가지고 있는 약과 전혀 중복되지 않아서 분야를 넓힐 수 있는 부분을 찾는다든지 하는 것이다. 한편 아무리 전망이 좋아 보여도 경쟁이 심하다면, 이 부분도 아주 조심해서 상업적 이득에 대한 분석을 하여야 한다. 항암제의 경우 표적이 잘 듣는다 하더라도, 정상 세포와 암세포를 분별하여 표적하지 못한다면 좋은 표적이라 할 수 없다. 단지 비임상 특히 시험관내 실험이 생체 반응을 적절히 반영하지 못하는 경우에는, 적합한 모델을 찾아 증명을 하거나 또는 비임상 동물 실험에서 증거를 찾아야 한다. 또한 치료 지수가 너무 좁으면 이상반응이 심각할 것이 우려되므로 충분한 검토가 필요하고, 약물 상호 반응에 대한 검증도 필요하다.
4. 초기 임상 개발 단계의 전략
1) 임상 시험 단계에서 고려하여 할 사항들
* 제안된 적응증이 unmet needs에 부합하는가?
* 가고자 하는 적응증을 개발함에 있어서, 시장 진입에 심각한 지연을 요구하는 추가적인 데이터가 필요한가?
* Orphan 적응증을 고려한다면 임상시험을 할 수 있을 만한 환자수가 되는가? 이 경우 어떻게 위험을 최소화 할 것인가?
* 첫 적응증을 얻은 후, 얼마나 많은 추가적인 적응증을 빠른 시간 안에 얻을 수 있을 것인가?
* 약물이 기존의 치료를 바꿀 수 있을 것인가?
* 경쟁약에 비해 편리한지?
* 혹시 더 복잡하거나 또는 보다 공격적으로 (invasive) 치료하여야 하는지? 만약 이런 경우라면, 효능이 더 좋다던지, 더 안전한지 등의 약물의 특장점을 찾지 않으면 시장에서 살아나기 쉽지 않을 것이다.
2) 초기 임상 개발 전략
신약 개발의 초기에 임상 개발 전체에 대한 전략이 세워져 있어야 한다. 다시 말하면, 궁극적으로 가고자 하는 적응증에 대한 준비가 되는 초기 임상을 실시하여야 한다. 우리 나라의 경우 글로벌 신약을 개발함에 있어서, 미국과 유럽의 법제 기관을 고려한 개발 전략과 더불어 동북아 나라들, 즉 일본, 중국의 개발 전략을 고려하여 초기 임상의 adoptive design 및 translational research 에 대한 전반적인 계획을 세우고 실시하는 것이 실제적이다. 고식적인 임상 1상 시험은 용량제한 독성과 최대순응용량을 발견하여 2상 임상시험 용량을 정하기 위함이다. 또한 고식적인 임상시험 대상 환자군은 biomarker 를 고려하지 않은 모든 암환자를 대상으로 하는 경우가 대부분이다. 그러나 새로운 translational phase I trial은 biomarker로 선택된 환자군에서 시험하는 것으로, 고식적인 1상의 최종 목표에 biomarker 반응 등을 보는 새로운 design으로 가는 것이다. 또한 1상과 2상을 한 임상시험에 연결시키거나, 1상의 확장군에 보다 많은 환자를 넣어 개념증명(POC)의 목표를 넣음으로써, 될 수 있으면 빠른 시간 안에 3상 임상시험으로 갈 수 있도록 준비하는 것이다.
5. 후기 임상 단계에서 개발 전략
1) 임상개발계획의 수립
신약의 임상 개발 계획은 1상 임상 시험 시작 전, 즉 약을 임상으로 간다는 결정을 하는 시점에 이미 전체적인 그림을 가지고 시작하여야 한다. 실제로 그 시점에서 2/3상으로 갈지 말지 하는 결정은 되어 있지 않더라도, 1상의 결과에 대한 모든 시나리오를 가정한 후 어떤 2상 또는 3상을 할 것인지, 어떤 적응증을 최우선으로 갈 것인지 등에 대한 구체적인 그림이 있어야 한다. 이는 특허전략까지도 고려하여야 하고, 궁극적으로는 에버그린 전략과도 통하여 한다.
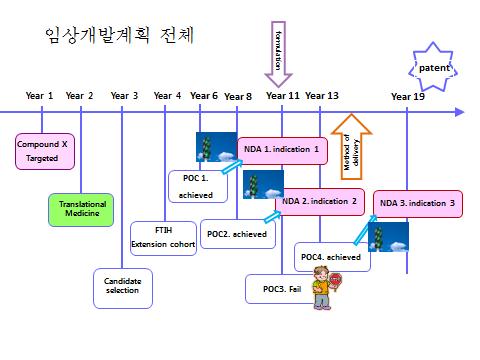
2) 글로벌 개발 전략
만약 약의 궁극적인 개발이 글로벌 신약이라면, 첫번째 관문이 구미가 될지 동북아가 될지를 정하는 것이 중요하다. 물론 미국과 유럽에 등록한 후 다른 나라에 등록할 수도 있겠으나, 일본과 중국은 법제 기관의 요구가 뚜렷하여 임상시험 없이 등록하기는 불가능하기 때문이다. 만약 NDA를 동북아에서 하기를 원한다면 여러 가지 점을 고려하여야 한다. 이 시점에서 어떤 질환을 선택할 것인지 지역적으로 어느 곳을 먼저 공략할 것인지를 전체적인 그림 위에 순서를 설정하고 이에 따라 신약개발을 진행하여야 한다.
[참고문헌]
1. Targeting Cancer: Innovation in the Treatment of Chronic Myelogenous Leukemia, NEHI Innovation Series 2004.
2. Knowls J and Gromo J. Target selection in drug discovery 2003, 2, 63.
3. 문한림, 2012년도 기술마케팅아카데미 (보건복지부, 한국보건산업진흥원 지원 사업개발 및 라이센싱 전문인력 양성과정), 서울 2012.
4. 문한림, 동북아 항암제 개발 전략, KJPM. 2012, 8.
