2014년 FDA 승인으로 본 신약 허가 동향
정원희. (재)범부처신약개발사업단 전문위원
1. 들어가면서
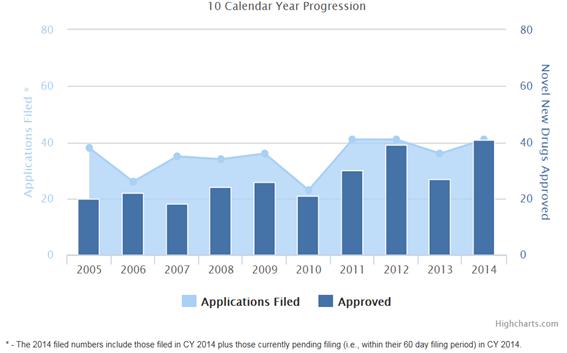
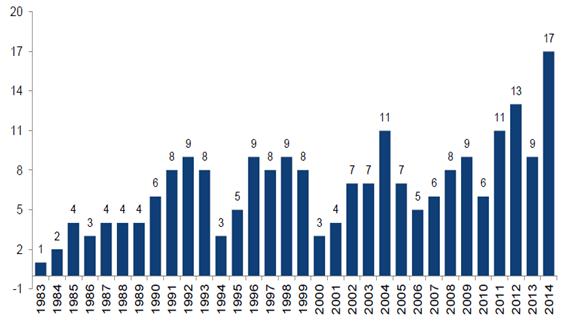
FDA 최근 발표자료에 따르면 2014년 승인된 신약은 41개로 나타났다. 이는 신약 승인이 다소 저조했던 2013년의 27개보다 14개 (52%) 증가한 수치이며 2000년대 이후 가장 높은 수치이다. 2014년 신약 승인 현황을 세부적으로 살펴보면 과거와 비교하여 단순 수치 증가 뿐 아니라 의미 있는 변화들이 감지되고 있다. 본 기고문에서는 2014년을 포함한 최근 FDA 신약 승인 자료를 고찰하여 신약 허가동향의 트랜드를 분석하고자 한다.
<최근 10년 간 FDA 신약 승인 현황 >
 2. 질환 영역별 동향
2. 질환 영역별 동향
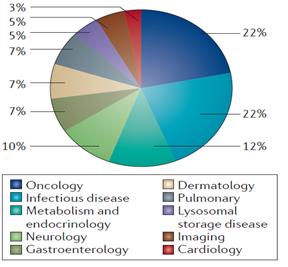
2014년 승인 약물 중 항암제와 항감염제의 비율이 각각 22%로 가장 많은 비중을 차지하고 있는 것으로 나타났으며 대사/내분비 질환 (12%), 신경계 질환 (10%) 등도 다수를 점유하고 있는 것으로 나타났다. 2013년 승인 현황과 비교할 때, 항감염제의 비율이 2배 가량 크게 증가했고 대사/내분비 질환 관련 약물의 비율 또한 소폭 증가했다. 반면, 2012, 2013년 연속 30% 이상의 비율을 점유하던 항암제의 비율은 감소했으며 심혈관계 약물의 비율 또한 4% 감소한 것으로 나타났다. 가장 눈에 띄는 항감염제의 비율 상승은 새로운 HCV 치료 약물의 승인과 더불어 항생제 개발 촉진법 (GAIN: Generating Antibiotic Incentives Now Act)에 근거를 둔 우수 감염증 치료제 (QIDP: Qualified Infectious Disease Product) 제도의 영향에 기인하는 것으로 판단된다. 한편, 획기적치료제 (Breakthrough Therapy)로 지정 받은 약물들의 질환 분류를 살펴보면, 혈액질환 치료제의 비중이 가장 높은 것으로 나타났다.
<2014 질환 분야별 승인현황>
 3. BLA (Biologics License Application)
3. BLA (Biologics License Application)
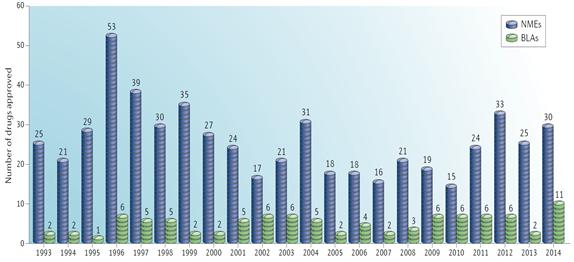
생물학적 제제 품목허가 (BLA, Biologics License Application) 승인 건수는 2014년 11건 (27%)으로 단 2건 승인에 그쳤던 2013년과 매해 6건의 BLA가 승인된 2009년∼2012년과 비교하여 증가한 승인 실적을 나타내었다.
<1993∼2014년 NME 및 BLA 승인 현황>
 4. First-in-Class 및 Breakthrough Therapy Designation
4. First-in-Class 및 Breakthrough Therapy Designation
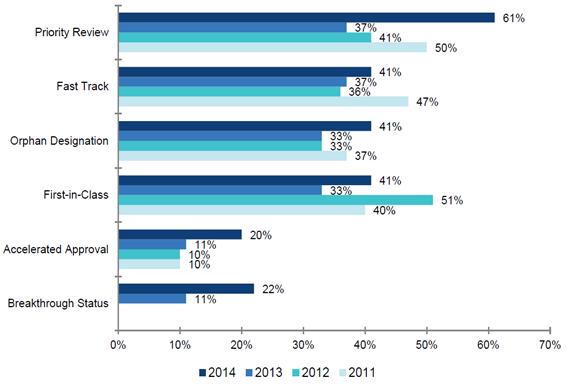
2011∼2013년 Frist-in-Class (계열최초 진입 약물) 약물 비중은 2011년 40% (12개), 2012년 51% (20개), 2013년 33% (9개)로 나타났으며 2014년의 경우에는 41% (17개)로 나타났다. 한편, FDA는 2014년 승인 약물 중 만성 C형 간염치료제인 길리어드 사이언스의 Harvoni (NS5A inhibitor 및 HCV nucleotide-analogue NS5B-polymerase inhibitor), 흑색종 치료제인 머크의 Keytruda (PD1-specific antibody), 머크의 항혈소판제 Zontivity (Protease-activated receptor 1 antagonist)등을 주목해야 할 First-in-Class 신약으로 제시한 바 있다. 또한 FDA는 백혈병 치료제인 암젠의 암젠의 Blincyto (CD19, CD3-bispecific antibody), 흑색종 치료제인 비엠에스의 Opdivo (PD1 inhibitor) 등 9개 품목을 Breakthrough Therapy Designation (획기적 치료제 지정)으로 결정했다. 이는 2013년 (3개 지정)과 비교하여 크게 증가한 수치이다.
<2011∼2014 승인 신약의 유형별 분류>
 5. 희귀질환 치료제
5. 희귀질환 치료제
희귀질환에 대한 정의는 나라마다 조금씩 차이가 있으나 FDA는 환자 수 20만명 이하에 해당하는 질환의 치료제를 희귀의약품으로 정의하고 있다. 2011∼2013년 희귀질환 치료제 비중은 2011년 37% (11개), 2012년 33% (13개), 2013년 33% (9개)로 나타났으며 2014년의 경우에는 41% (17개)로 증가하였다. FDA는 2014년 승인된 희귀질환 치료제 중 바이오마린의 Vimizim (모르키오 A 증후군), 사노피아벤티스의 Cerdelga (고셔병), 얀센의 Sylvant (다발성 캐슬만씨병), 로슈의 Esbriet (특발성 폐 섬유증), 베링거인겔하임의 Ofev (특발성 폐 섬유증) 등을 주목할 만한 희귀질환 치료제로 제시한 바 있다. 한편, 세계보건기구(WHO)는 진단기술의 발달로 이전에 진단하지 못했던 희귀질환을 찾아내는 경우가 많아질 것으로 예상하고 있으며 제약기업들 입장에서도 희귀질환 치료제 개발이 상대적으로 낮은 승인장벽, 특허 독점기간과 개발비용에 대한 세제혜택 등에서 유리한 점이 존재하므로 희귀질환 치료제 개발은 앞으로 더욱 활발해질 것으로 예상된다.
<1983∼2014년 희귀질환치료제 승인 현황>
 6. 글로벌 매출액 (2019년) 예상
6. 글로벌 매출액 (2019년) 예상
Thomson Reuters Cortellis 분석 자료에 따르면 2014년 승인 약물 중 전체의 12개 (29%)가 2019년에 매출액 1 billion USD를 달성할 것으로 예상되었다. 이 약물들 중에서도 C형 간염 치료제 Harvoni (Ledipasvir plus sofosbuvir), programmed death receptor-1 차단 항암제인 Opdivo (Nivolumab) 및 Keytruda (Pembrolizumab) 등 3개 품목은 매출액 3 billion USD를 초과하는 매출액을 달성할 것으로 전망되었다.
<2019년 글로벌 매출 전망>
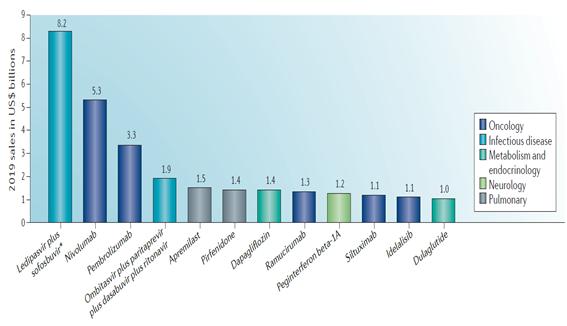
* Sales of Gilead’s combination of ledipasvir plus sofosbuvir are expected to peak at US$12 billion in 2017.
7. 마치면서
2014년은 2000년대 이후 가장 많은 허가 승인이 이루어진 가운데, 희귀질환 치료제의 승인이 활발했으며 질환 분야별로는 항감염제의 비중이 증가하였다. 항암제의 경우, 면역항암제의 부상이 두드러지는 한 해였으며 앞으로도 면역항암제의 적응증 확대, 타 항암제와의 병용요법 탐색 등 활발한 개발이 진행될 것으로 예상된다. 한편, 2015년 2월 현재, 노바티스의 interleukin-17 표적 건선치료제 및 화이자의 CDK inhibitor 유방암 치료제가 승인된 것을 비롯하여 CETP inhibitor, PCSK9-specific antibody 등 신규 고지혈증치료제, oncolytic virus 항암제 등 다양한 파이프라인의 임상 후기 개발 및 승인이 연내에 예상되고 있어 의학적 미충족 수요를 타겟으로 하는 First-in-Class 혁신신약 개발 경쟁은 보다 치열해질 것으로 전망된다.
<참고자료>
1. New Molecular Entity and New Therapeutic Biological Product Approvals for 2015.
Food and Drug Administration, 2015
2. New Molecular Entity and New Therapeutic Biological Product Approvals for
2014. Food and Drug Administration, 2015
3. New Molecular Entity Approvals for 2013. Food and Drug Administration, 2014
4. New Molecular Entity Approvals for 2012. Food and Drug Administration, 2013
5. New Molecular Entity Approvals for 2012. Food and Drug Administration, 2013
6. New Molecular Entity Approvals for 2011. Food and Drug Administration, 2012
7. Mullard A. 2014 FDA drug approvals. Nat Rev Drug Discov 2015;14(2):77-81
8. Mullard A. 2013 FDA drug approvals. Nat Rev Drug Discov 2014;13(2):85-89
9. Mullard A. 2012 FDA drug approvals. Nat Rev Drug Discov 2013;12(2):87-90
10. 문성은, 이장익, 미 FDA의 신약허가 취득을 위한 전략적 접근 방법에 관한 고찰. FDC
법제연구 2013;8(1,2):79-88
11. Drug Approvals Reveal and Industry Shift to Niche Disease. Global Data, 2015





