단일 또는 이중표적 Anti-angiogenic antibody 물질의 개발 및 기술이전
이원섭 연구소장, 파멥신
㈜파멥신은 2008년 10월에 보건산업진흥원과 KOTRA가 기획한 GATE project (Get Armed to Explore Global Market)에서 대상을 수상한 한국생명공학연구원 출신 연구원들이 주축이 되어 항체신약을 개발하고자 하는 모토로 출발하였다.
2008년 당시에 ㈜파멥신에서 개발 중이던 항체가 현재 호주에서 임상 2상을 진행 중에 있는 anti-VEGFR2 항체인 Tanibirumab이다. Tanibirumab이 targeting하는 VEGFR-2는 종양의 성장과 전이에 관여하는 신생혈관형성 인자 중 VEGF에 대한 수용체인데 VEGF/VEGFR-2 신호와 관련하여 이미 많은 의약품들이 시판되고 있고 또한 임상시험을 진행 중에 있다. 가장 대표적인 합성의약품으로는 Sutent가 있고, 항체 또는 단백질 의약품으로는 Avastin, Lucentis, Eylea, Cyramza가 있다. 이들 물질들은 종양이나 안과질환 등에 사용되고 있다. 특히 Cyramza는 Tanibirumab과 같은 VEGFR-2를 표적으로 하는 항체로 2014년 전이성 위암에 대하여 허가를 받았으나, Tanibirumab이 임상1상을 시작한 2011년경 에는 임상 2/3상을 수행하던 시기로 아직 허가를 받기 이전이었다. Tanibirumab가 가지고 있는 독특한 position은 이종간 교차반응을 보유하고 있는 것으로 이러한 특성을 이용한 translational research를 진행할 수 있다. 이러한 차별점은 Tanibirumab으로부터 혜택을 받을 수 있는 질환과 임상시험에 대한 설계를 도모할 수 있는 장점이 되며 또한 임상 성공률 제고 및 임상비용을 절약할 수도 있다.
Cyramza 개발을 진행하기 이전에 Imclone에서는 IMC-1C11이라는 anti-VEGFR2 항체를 개발하고 있었으며, 이 항체로 임상 1상을 성공적으로 진행한 경험이 있었다. 또한, 벨기에의 UCB pharma로부터 CDP-791이라는 pegylated anti-VEGFR2 diFab 항체도 개발하였으나 이들 모두 임상 1상을 완료한 후에 원 개발사에 돌려주거나 더 이상의 임상 개발을 진행하지 않았던 전례가 있어서 Cyramza의 개발이 지속될 것인지에 대한 확신이 없었다. 따라서, (주)파멥신에서는 Tanibirumab의 개발 초기에는 First-in-Class를 목적으로 개발하게 되었다. 그러나, Tanibirumab의 임상 1상이 완료된 2014년 Cyramza가 허가를 받기에 이르렀고, 이후 Tanibirmab은 동물 유효성 시험에서의 결과를 바탕으로 Tanibirumab에 효능을 보이는 질환으로 개발하는 것으로 목표를 수정하였다. 현재 호주에서 진행 중에 있는 재발성 교모세포종에서의 임상2상은 이러한 동물에서의 효능 평가 결과를 바탕으로 설정된 것이다.
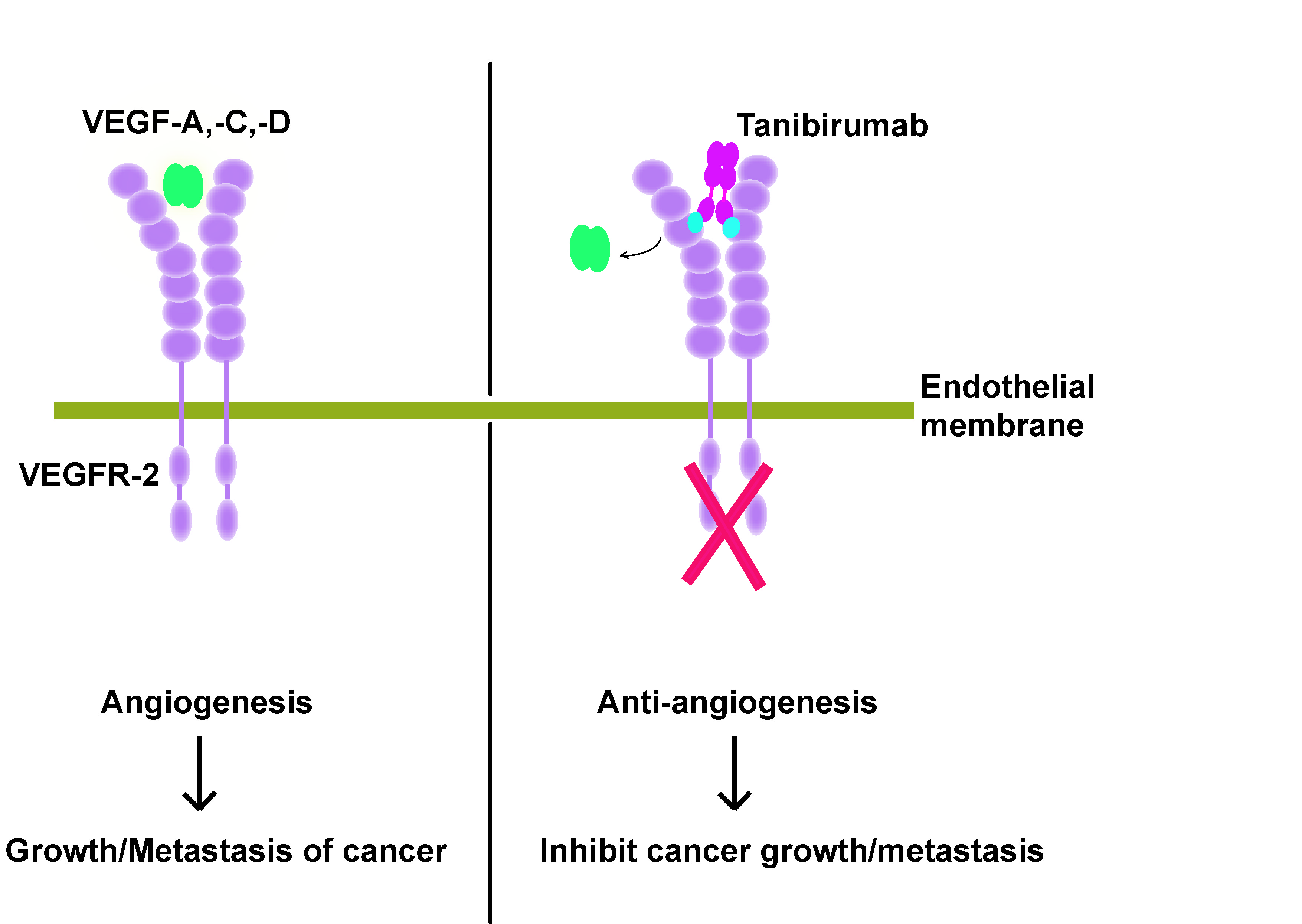
Figure 1. Mode of Action of Tanibirumab
Cyramza 개발이 이미 Tanibirumab 보다 앞서서 진행 중에 있었기 때문에 임상에서의 안전성이 입증이 되지 않은 상태에서 기술이전은 상대적으로 쉽지 않은 상태였다. 임상 1상에서 Tanibirumab의 안전성이 입증됨에 따라 2014년에 2건의 기술이전이 국내 및 중국 업체와 체결되었다. 국내업체의 경우 혈관신생을 억제하는 물질들이 안과질환인 노인성 황반변성 등에 진입하는 것에 고무되어 Tanibirumab을 안과질환에 적용하기 위한 목적이 있었으며 중국업체의 경우 중국 내에서 위암 등에 적용 및 개발하기 위하여 계약을 체결하였다. 현재 두 회사 모두 열심히 개발에 매진하고 있는 것으로 파악되고 있다.
신생혈관형성에 관여하는 인자는 VEGF외에도 PlGF, Angiopoetin, PDGF, HGF, FGF, VE-cadherin등 많은 인자가 관여할 수 있다. 일반적으로 VEGF-A에 대한 항체인 Avastin을 treat하는 경우 초기에는 항암효과가 현저히 나타나다가 반복되는 treatment에 의하여 Avastin에 대하여 내성이 나타나는 것으로 알려져 있다. 이 경우에 종양은 VEGF-A외에 FGF등과 같은 다른 신생혈관형성 인자에 의해 유도될 수 있다. 이러한 아바스틴 내성에 대한 극복과 신생혈관형성 억제능을 향상 시키고자 ㈜파멥신에서는 VEGF/KDR 신호와 Angiopoietin-Tie2 신호를 동시에 억제할 수 있는 IgG format의 이중표적억제제를 개발하였다. Angiopoietin-2는 VEGF와 유사하게 신생혈관형성의 초기에 혈관세포의 migration등에 관여하는 것으로 알려져 있으며 현재 Amgen이나 Regeneron등에서 Angiopoietin-2를 표적으로 항암제 또는 안과질환 치료제로 개발하고 있다. Angiopoietin-1은 신생혈관의 형성의 마지막 단계인 Pericyte recruitment등과 같이 vessel stabilization 또는 vessel maturation에 관여하는 것으로 알려져 있다. 이들 Angiopoietin의 수용체가 Tie-2이며, Angiopoietin의 활성은 multimer 상태에서 최적의 활성을 나타낸다고 알려져 있다. PMC-001은 KDR(VEGFR-2)와 Tie-2에 결합하는 IgG format의 이중표적 항체이다.
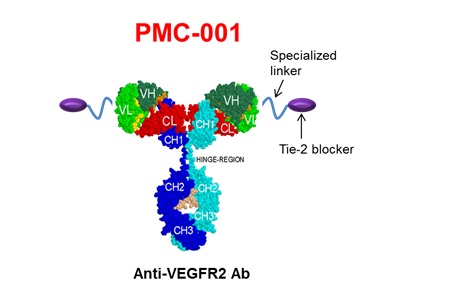
Figure 2. Shematic Diagam of PMC-001
이중표적항체는 하나의 표적에 결합하는 전형적인 항체보다 동일한 메커니즘에 관여하는 두 개의 신호전달체계를 억제함으로써, 효능의 증진 및 약물내성을 극복할 수 있다. 또한, 두 개의 물질을 독립적으로 개발하는 것에 비하여 하나의 물질로 개발하기 때문에 개발비용을 상당한 정도로 절감할 수 있는 장점이 있다. 이것은 기존에 허가 받은 약물과 병용치료를 고려한다고 해도 마찬가지라고 할 수 있다. 물론, 전형적인 항체가 아니기 때문에 물성에서 문제점이 발생할 수 있고, 두 개의 신호체계 각각에 대한 용량조절에 한계가 있다는 점은 단점이 될 수 있다.
PMC-001은 아바스틴의 반복 투여에 의해 유도된 아바스틴 내성 교모세포종 모델에서 효능을 입증하였으며, 삼중음성유방암 (triple negative breast cancer) 및 췌장암 모델에서와 같은 현재 마땅한 치료제가 없는 종양질환모델에서 효능을 확인하였다. 특히, 췌장암 모델에서의 효능은 PMC-001의 기술이전에 있어서 중요한 자료가 되었다. PMC-001의 기술이전은 2014년에 이루어 졌다. 이 시기는 (주)파멥신의 플래그쉽 항체인 타니비루맵의 임상1상의 결과가 완료되어 타니비루맵의 안전성이 입증되었던 시기이다. PMC-001을 In-licensing한 기업은 Celgene으로부터 투자를 받아 설립된 Triphase라는 캐나다 회사로 이 당시 Celgene의 가장 큰 관심사 중 하나는 췌장암 치료제로 사용되는 자사의 블록버스터 Abraxane의 효용성을 증가시켜 줄 수 있는 물질을 찾는 것이었습니다. 이러한 상황에서 PMC-001의 췌장암 동물모델에서의 효능은 기술이전계약이 성사되는데 있어서 중요하게 기여하였다. 이후에 타니비루맵의 기술이전 받은 중국의 3SBio와 PMC-001에 대하여 기술이전계약도 성사되게 되었다. 캐나다와 중국회사에 기술이전을 하게 됨으로써 어려웠던 점은 두 회사가 동일한 세포주를 사용하고자 하였으나, ㈜파멥신에서 사용하였던 세포주의 지적재산권을 소유한 회사에서 중국업체가 사용하는 것에 대하여 허가를 주지 않았던 점이다. 따라서, 지적재산권이 상대적으로 자유로운 새로운 세포주를 만들 수 밖에 없었고 이것이 전체적인 개발기간을 지연시키는 원인이 되었다. 세포주와 같은 기반기술은 최신기술도 중요하지만 이 기술의 이용이 얼마나 자유로운지 미리 검토하는 것도 필요하다고 할 수 있다.
㈜파멥신은 타니비루맵 및 PMC-001과 같은 혈관 형성 조절 물질 외에 immune checkpoint 항체와 다수의 이중표적 항체를 개발하고 있다.
이전
2016.10.04
다음
2016.12.05