Proteinopathy* 치료의 새로운 접근법
[*Proteinopathy: Protein misfolding으로 인한 비정상적인 단백질 구조가 축적되어 세포의 정상 기능이 방해되는 질환]
(본 기고는 Nature Review Drug Discovery (18, 665) 2019년 9월호에 게재된 “A novel approach to reverse proteinopathies”의 내용을 바탕으로 작성하였다.)
ADTKD-MUC1 (Autosomal dominant tubulointerstitial kidney disease-MUC1, MUC1 신장병)은 일종의 상염색체 우성 유전질환으로 발병이 더디고 그 병리기전이 알려지지 않아 현재 사용되는 치료제가 없는 상황이다. Dvela-Levitt 연구팀이 Cell 지에 보고한 자료에 따르면, ADTKD-MUC1은 독성을 나타내는 일종의 proteinopathy임이 밝혀졌고, 축적된 비정상 단백질을 신규 small molecule로 제거할 수 있다는 연구 결과를 발표하였다.
Mucin 1 (MUC1)은 세포막 Mucin의 일종으로 주로 상피 조직에서 발현되어 점액을 분비하는 역할을 한다. 이 MUC1에 Frameshift 돌연변이인 ADTKD-MUC1 유전자를 지닌 환자는 그 결과로 전체 단백질이 중간에서 절단된 형태인 MUC1fs를 발현한다. MUC1fs와 ADTKD의 연관성을 분석하기 위해 저자는 우선 MUC1 Frameshift 돌연변이의 이형접합(heterozygous) 환자의 신장 생검 시료에서 wild-type의 MUC1wt단백질과 MUC1fs단백질의 세포내 분포 패턴을 분석하였다. 그 결과, MUC1wt는 신장 세관과 집합관 (tubule and collecting duct cells의 apical membrane에서 분포하는 반면, MUC1fs는 세포막으로 이동되지 않고 세포내에 축적됨을 확인하였다. 이 결과를 재현해내기 위해, (1)인간 MUC1fs 대립유전자 (allele)가 이형접합으로 knock-in 된 +/MUC1fs mouse-model (2) 환자유래 만능줄기세포에서 만들어진 신장 organoid (3) 환자유래 세관 상피세포주에서 재확인하였다. 이 결과에서 주목해야 할 점은, +/fs mice가 실제 ADTKD-MUC1환자와 유사한 형태의 세뇨관 병리를 나타냈다는 것이다.
Dvela-Levitt 연구팀은 Mucin의 분비 경로에 존재하는 다양한 마커를 활용한 Immunofluorescence 패널 분석을 통해 MUC1fs가 cis-Golgi와 cargo 수용체인 TMED9를 발현하는 vesicle 내부에 축적됨을 확인하였다. TMED9는 Golgi-ER간의 역방향 수송 (retrograde transport)에 관여하는 수송 단백질이다.
다음으로 저자는 MUC1fs 축적이 unfolded protein response를 촉발시키는지 여부를 알아보기 위한 실험을 진행하였다. UPR은 ER stress가 누적되었을 때 세포 내 항상성을 유지하기 위한 반응이다. RNA 시퀀싱 데이터와 단백질 수준에서의 UPR을 검증하는 추가 연구를 분석한 결과, 대조군 (+/+) 세포 대비 +/MUC1fs세포에서 UPR 반응의 일부인 ATF6가 상향조절되어 있음을 밝혔다. 또한, ATF6가 저해되면 +/MUC1fs 세포에서의 MUC1fs 축적이 더욱 악화되어 대조군 세포 대비 세포사멸이 증가하였다. 실제로, 일반적인 ER stressor인 thapsigargin을 처리하면 in vitro와 in vivo에서 +/MUC1fs세포의 세포사멸이 증가된다. 그러므로, MUC1fs가 축적되면 독성 proteinopathy가 일어나는데 이때 ATF6가 활성화되어 세관 상피세포를 이런 독성으로부터 보호하려 한다는 것이다.
저자는 이러한 MUC1fs의 축적을 제거할 수 있는 (즉, 세포독성이 없으면서 MUC1fs의 양을 30% 이상 감소시킬 수 있는) small molecule 모핵을 찾기 위하여 3713개의 repurposing 약물 라이브러리를 스크리닝 하였다. 활성이 있는 203개의 유효물질 중 약물의 용량 범위를 확장시켜 2차스크리닝을 진행하였고, 이 과정에서 (1) MUC1wt의 양 또는 MUC1fs mRNA의 양을 감소시키거나, (2) +/MUC1fs 세포에서 thapsigargin에 의한 세포사멸을 억제하지 못하는 물질은 제외시키는 선별 기준을 정하여 최종 선도 물질로 BRD4780을 도출하였다.
BRD4780을 +/fs mice에 투여하면 신장에서 MUC1fs의 양은 감소하고 MUC1wt양은 유지되었다. 환자유래 신장 organoid에서도 유사한 결과를 확보하였다. 시간별로 관측한 실험에서, 분비경로가 정상적으로 작동하는 경우에만, BRD4780은 MUC1fs가 endosome과 lysosome으로 이동하는 것을 촉진하였다. 실제로, TMED9의양은 +/MUC1fs세포에서 증가하였고 TMED9 이 deletion되면 BRD4780가 MUC1fs 축적에 미치는 효과와 동일한 결과 (phenocopy)를 보였다. 기전적으로 저자는 BRD4780이 직접 TMED9에 결합하면 초기 분비경로에서 정지되어 있던 MUC1fs가 라이소좀으로 이동되어 분해되도록 한다고 제안하였다.
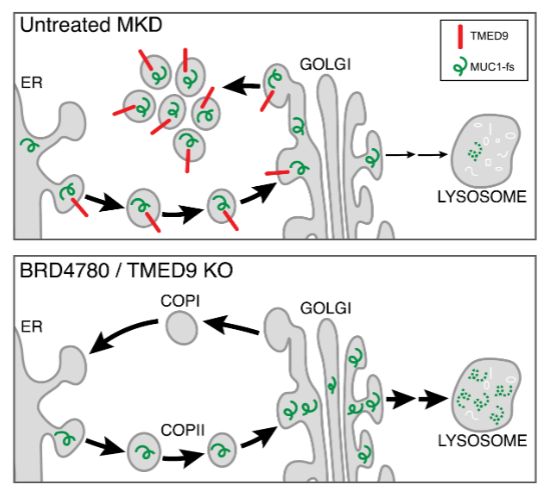
그림 1. BRD4780의 작용기전 모식도. BRD4780이 TMED9에 결합하거나
TMED9이 deletion된 경우에는 COPI-cis-Golgi-COPII로부터 정지되어 있던
MUC1fs가 분비경로에서 역방향으로의 이동이 가능해져서 라이소좀에서 분해된다.
분비경로에 축적된 misfolding 단백질의 제거를 촉진하는 이런 BRD4780의 역할은 신장 및 기타 장기에서 생기는 다른 종류의 proteinopathy로도 확장될 수 있다. 예를 들어 세포주 실험에서 BRD4780은 ADTKD-UMOD를 일으키는 uromodulin 돌연변이체의 양과 색소성망막염(retinitis pigmentosa)를 일으키는 rhodopsin 돌연변이체의 양을 감소시켰다. 이는 BRD4780가 독성 proteinopathy의 치료제로서 광범위한 잠재력이 있음을 보이는 연구 결과이다.
본 연구는 치료제가 없는 다양한 proteinopathy에서 보여지는 단백질 축적으로 인한 독성을 완화하는 새로운 접근법을 제시하였고 BRD4780은 치료제 개발을 위한 선도물질로서 가치를 제공하였다.
원문출처: Dvela-Levitt, M. et al. Small molecule targets TMED9 and promotes lysosomal degradation to reverse proteinopathy. Cell 178, 1–15 (2019)
이전
다음